ETERLER VE EPOKSİTLER
Eter denildiğinde genelde tıpta anestetik olarak kullanılan dietileter (Et-O-Et) akla gelir. Oysa dietileter eterler diye bilinen bir organik seriden sadece biridir. Eterler bir oksijen molekülüne iki organik grubun bağlı olduğu yapılardır (R-O-R). Oksijen atomunun sadece iki bağ yaptığı hatırlanırsa bu moleküllerin oksijene tekli bağlı iki grup olacağı rahatça anlaşılabilir. Genel olarak R-O-R olarak gösterilen eterlerde R=R durumunda simetrik eter R ve Rnun farklı olması durumunda ise simetrik olmayan (asimetrik) eterler olarak adlandırıldığını hatırda tutunuz. Epoksitler ise aslında halkalı eterlerin en küçüğü olan üçlü halkalı eterlerdir.
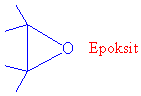
Epoksitler konu içerisinde daha detaylı anlatılacaktır.
Eterlerin adlandırılmaları
Eterler genelde her iki gruptan (alkil yada aril) adları söylenerek ve eter eki getirilerek isimlendirilir.
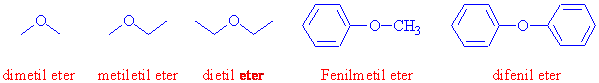
Adlandırma esnasında IUPAC kuralına uyularak gruplarına harf sırasına göre dizildiğine dikkat ediniz. Bazı komplike durumlarda (daha öncelikli bir fonksiyonel grubun bulunması gibi) -OR gruplarının küçük olanı alkoksi grubu olarak adlandırılır.
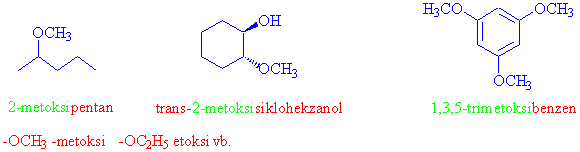
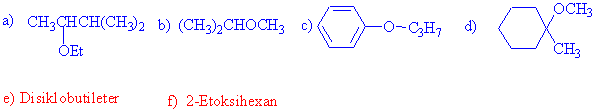
A/ Aşağıdaki formülleri verilen bileşikleri adlandırmaya, adları verilen bileşikler için bir formül yazmaya çalışınız.
Eterlerin kaynama noktaları aynı sayıda karbon atomu içeren alkollere göre daha düşüktür. İşin aslında eterler o kadar düşük kaynama noktalarına sahiptirler ki, nerede ise -O- atomu yerinde -CH2- grubu bulunan doymuş hidrokarbonlarla aynıdır. Aşağıdaki sonuçları bu durumları anlamak için karşılaştırınız.
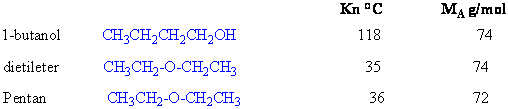
Yapılarında oksijen atomuna direkt bağlı bir hidrojen atomu olmadığı için eter molekülleri birbiri arasında hidrojen bağı yapamazlar. Kaynama noktalarının bu kadar düşük olma sebebi budur.
Eterlerin çözücü özellikleri
Eter fonksiyon grubu diğer fonksiyonel gruplarla karşılaştırıldığında oldukça inertdir (reaksiyon vermeye yatkın değildir) diyebiliriz. Genelde alkoller kolayca yükseltgenme, indirgenme reaksiyonu vermedikleri gibi zayıf asit ve bazlara karşıda inerttirler. Metalik sodyum ile de reaksiyon vermemesi eterleri alkollerden ayırmanın bir kolay yolu olarak bilinir. Organik reaksiyonlarda çözücünün reaksiyona katılmaması en önemli tercihlerden biri olduğu düşünülürse, eterlerin neden çok önemli bir çözücü olduğu sanırım daha kolay anlaşılacaktır. Eterler düşük kaynama noktaları dolayısıyla extraksiyonda organik molekülleri ayırt etmek amacı ile en çok kullanılandır. Düşük kaynama noktaları, kolayca uçurulup geri kazanılmasını sağlar. Eterlerle çalışılırken yanıcı olduğuna ve uzun süre açık havada bekleyen eterlerin patlayıcı peroksitlere dönüştüğüne çok dikkat edilmelidir

Uzun süre açık da bırakılmış eterler susuz demir sülfatla çalkalanarak çok patlayıcı peroksitlerinden kurutulabilir.
Grignard reaktifleri : (Bir karbanyon kaynağı)
Eterlerin en önemli çözücü olarak kullanıldığı yer Grignard bileşiklerinin hazırlanmasında kendini ortaya koyar. Organik kimyada ki en önemli buluşlardan biri olan ve bulucusu Grignarda nobel ödülü kazandıran bu moleküller, sentetik organik kimya için vazgeçilmez reaktiflerdir.
Grignadın bulduğu eğer magnezyum parçaları eterde çözünmüş bir alkil veya aril halojenürle şiddetli çalkalanarak reaksiyona sokulursa ekzotermik bir tepkime verdiği idi. Normalde eterde çözünmeyen magnezyum parçacıklar bir müddet sonra çözelti içerisinde kaybolarak Grignard reaktifi dediğimiz reaksiyonca çok aktif karbanyon kaynaklarını vermektedirler.
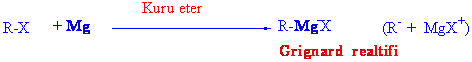
Reaksiyonda karbon halojen bağı kırılmakta ve ikisinin arasına magnezyum atomu yerleşmektedir. Normalde çok aktif olan bu maddelerin eterde hazırlanması, eterin reaksiyonca aktif olmamalarının yanında, oluşan molekülü koordinasyonla daha kararlı kılmaları da önemli bir özelliktir.

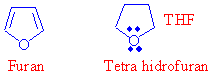
Eterlerin koordinasyonla kararlı kıldıkları bu Grignard reaktifleri, tepkimelerde kullanılırken koordine eterler gösterilmez. Genelde kullanılan iki tür eterden biri dietileter diğeri de THF ile gösterilen beşli halkalı bir eter olan tetrahidrofurandır.
Grignard bileşikleri adlandırılırken alkil- yada arilmagnezyum bromür şeklinde, sadece halojenin önünde bir boşluk olacak şekilde yazılır.
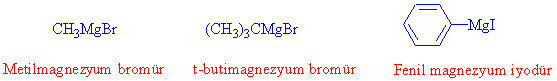
Grignard bileşikleri adlandırılırken alkil- yada arilmagnezyum bromür şeklinde, sadece halojenin önünde bir boşluk olacak şekilde yazılır.
Grignard reaktifleri, çok güçlü baz ve nükleofil olarak davranırlar. Grignard reaktiflerinin organik kısmı nerede ise iyonik kabul edilecek kadar polarlanmıştır.
|
|
ve hidrojen atomu bağlı herhangi bir hetero atom -OH, -SH,-NH la kolayca reaksiyon vererek hidrojen koparırlar |
![]()
Bundan dolayı Grignard reaktifi hazırlamada kullanılacak olan eterler tamamen sudan arındırılmış olmalıdır.
S- Yukarıdakine benzer olarak fenilmagnezyum bromürün etanol ile reaksiyonunu da sizler yazmaya çalışınız.
S-p-metoksibromobenzen, HOCH2CH2CH2Br , CH3OCH2CH2CH2Br molekülleri için Grignard reaktifini hazırlamak mümkün müdür ? Neden ?
A/ CH2=CH-CH3 ten CH3CHDCH3 hazırlanışını gösteriniz.
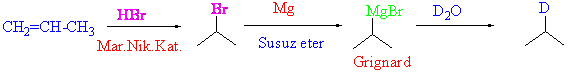
Grignard reaktifleri organometalik reaktifler olarak adlandırılır. Organik kimyada karbon metal bağı içeren moleküllere organometalik bileşikler denir. Örnek olarak yine organik kimyada fazlaca kullanılan organolityum bileşiklerini göstermekte gelenekseldir. Hazırlanışı Grignard reaktiflerine benzerdir.
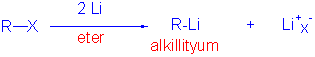
A/ Propillityumun hazırlanışı ve dötero su ile( ağır su=D2O) reaksiyonunu yazınız.
Eterlerin hazırlanışı
En çok kullanılan ve yaygın olarak bilinen eterin dietil eter olduğunu ku başında hatırlatmıştık. Dietileter yaygın bulunan iki organik molekül etanol ve sülfirik asitten hazırlanır.

Bu metot primer alkollerin simetrik eterlerini elde etmede çok kullanılan verimli bir metoddur.
A/ 1-Butanolden oluşacak eteride sizler hazırlayınız.
t-Butil metil eter ve t-Butiletil eter yenilerde çok önem kazanan iki eter türü örneğidir. Kurşunsuz benzinlerde oktan numarası artırıcı olarak kullanılmaktadır. Her ikisi de alkollerinin asit katalizörlüğünde 2-metilpropenle reaksiyonundan oluşur.
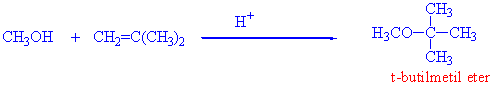
A/ Yukarıdaki reaksiyonun mekanizmasını tahmin etmeye çalışınız.
Williamson sentezi eterlerin laboratuarlarda sentezlenmesinde en çok kullanılan yöntemdir. Bu metot daha önceden bahsi geçen iki basamakta yürüyen bir tepkimedir. Birinci basamakta bir alkol sodyum yada potasyum metalleri ile alkoksitleri haline çevrilir.
![]()
İkinci basamak ta ise alkoksit ile bir alkilhalojenürün SN2 yer değiştirme reaksiyonudur.
![]()
A/ Williamson metodunu kullanarak aşağıdaki molekülleri sentezlemeyi deneyiniz.
![]()
(İkinci basamağın SN2 üzerinden yürüdüğüne dikkat ediniz)
Eterlerin parçalanmaları
Eterler oksijen atomu üzerinde elektron çifti bulundurduklarından Lewis bazı olarak davranırlar. Yani bu elektronlarını pozitif atomlara koordine kovalent bağ olarak da kısmen pozitif atomlara verebilirler. Eterler çok güçlü proton asitleri ve yine Lewis asidi olan bor halojenürleri ile tepkimeye girerler.
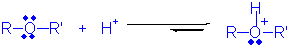
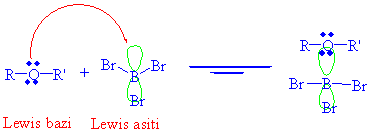
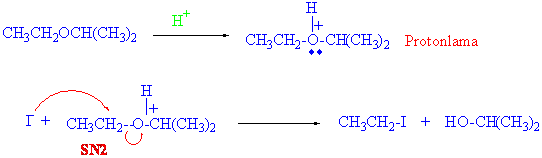
Bu reaksiyonlara dikkatlice bakıldığında, alkollerin asitlerle reaksiyonlarına çok benzediği görülür. Eğer ortamda I- yada Br- gibi güçlü nükleofiller varsa SN2 reaksiyonu üzerinden parçalanmalar olur.
![]()
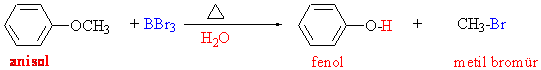
R veya R tersiyer olduğunda güçlü nükleofile de gerek kalmadan tepkime yürür. Çünkü bu reaksiyon artık kararlı karbokatyon oluşturabilir ve SN1 yada E1 üzerinden yürüyebilir.
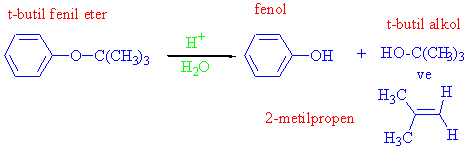
Yukarıda açıklanan reaksiyonlarda eter molekülündeki organik gruptan bir tanesinin ayrılması olayına eterlerin parçalanması denmektedir.
|
|
tepkimesi için bir mekanizma öneriniz . |
Epoksitler (Oksiranlar) bir oksijen atomu içeren üç halkalı bileşiklerdir.
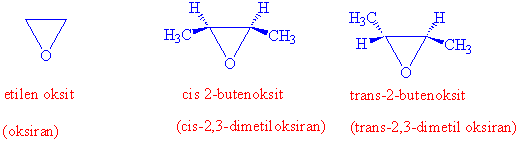
Sentetik olarak en önemli olan epoksit etilen oksittir ve sanayide sentezlenmesi etilenin gümüş oksit katalizörlüğünde oksitlenmesi ile yapılır.

Etilen oksit baklagillerin korunması haricinde genelde direk kullanım alanı çok az olan bir bileşiktir ve genelde diğer maddelerin hazırlanmasında çıkış maddesi olarak kullanılır. Örnek olarak etilen glikol ( 1,2-atanediol) yapımında kullanılması verilebilir.
Etilen oksidin hazırlanma tepkimesi kendine özel bir tepkimedir. Genel anlamda epoksitlerin hazırlanması genelde bir alken ve bir organik peroksiasitler yardımı ile yapılır.

Peroksi asitler, organik karboksilli asitlere bir fazla oksijen eklenmiş yükseltgen (oksijen veren) moleküllerdir. En çok kullanılan peroksi asetik asit ve m-kloroperbenzoik asittir (mPBA).
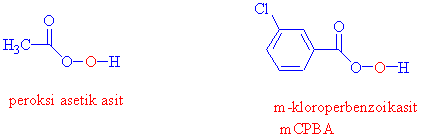
A/ Siklopenten ve mCPBAin reaksiyonunu ve ürününü yazınız.
Epoksitlerin tepkimeleri
Epoksitler üç atomlu halkalı yapı olduklarından halka yapısı oldukça gergindir. Atomların geometrileri yaklaşık 109.5 °C den 60°C civarına zorlanmışlardır. Bu da kolayca halka parçalanma reaksiyonu ile başka ürünlere dönüşmesini anlamamıza kolaylık sağlar. Örnek olarak normal eterlerin oldukça zor verdiği asit katalizörlüğünde su katma tepkimeleri ile glikollleri verirler.
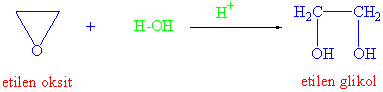
Etilen glikol çok miktarda üretilmekte ve genelde arabalar radyatörlerinde donma noktası alçaltıcı olarak kullanılır. Yukarıdaki reaksiyonun mekanizması,
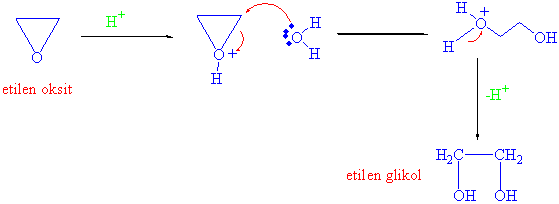
Epoksitlere diğer nükleofillerde aynı mekanizma ile tepkimeye girerler.
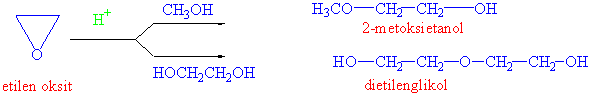
2-Metoksi etanol jet yakıtlarında yakıt borularındaki suların donmaması için katkı maddesi olarak kullanılmaktadır. Dietilen glikol ise plastikleri yumuşatıcı özellik gösterdiğinden bu amaçla çokça kullanılmaktadır.
Etilen oksit halkası Grignard reaktifleri ve organolityum bileşikleri ile de kalayca halka açılması tepkimeleri verirler.
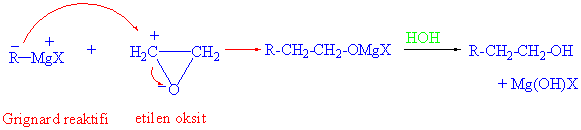
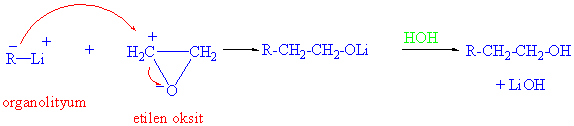
A/ Aşağıda verilen moleküllerin etilen oksitle ve sonrada su ile (hidroliz) tepkimelerini yazınız.
![]()
Halkalı eterler
Üçlü halkalı yapılara epoksitler denildiğini söylemiş ve bunları açıklamıştık. Şimdide üçlü halkalılardan daha büyük olan halkalı eterlere bir bakalım. Genel olarak tabiatta bulunan yapılar genelde beşli veya altılı yapıdadırlar. Beşli ve altılı yapıların açısal ve geometrik açıdan çok uygun olduğu daha önceleri anlatılmıştı.
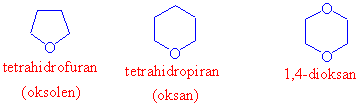
Tetrahidrofuran (THF) iyi bir çözücü olması yanında su ile karışabilmesi de ona iyi bir özellik kazandırmaktadır. Daha öncede açıklandığı gibi THF Grignard reaktiflerinin hazırlanmasında dietil eterden daha iyi bir solventdir. Her ikisi de eşit sayıda karbon atomu içermelerine rağmen THF halkalı yapıdadır ve halka oksijen üzerindeki elektron çiftlerini steerik açıdan (hacimsel) daha serbest bırakmıştır, magnezyumla koordinasyonu daha kolay olur. Tetrahidropiran ve dioksan da hem suda hem de organik çözücülerde çözünür.
Birden fazla oksijen atomu içeren büyük halkalı eterlerle de karşılaşmak mümkündür. Bu tür eterler son yıllarda çok dikkat çeken ve üzerinde çalışılan moleküllerdir. Bu moleküller crown eterler (taç eterler) olarak adlandırılırlar.
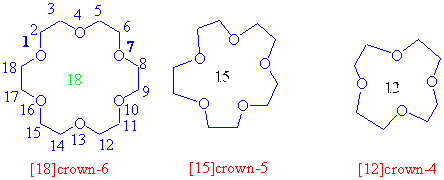
Yukarıda adlandırılan [18]-crown-6 için dikkat edilirse halka 18 atomdan oluşmuş ve bunların 6 tanesi oksijendir.
Crown eterler Na+, K+ gibi iyonları koordine edebilen moleküllerdir. Halka içerisindeki boşlukların büyüklüklerine bağlı olarak seçici bağlama yapabilmeleri kimyasal açıdan çok önemlidir. Örnek olarak [18]crown-6 K+ iyonunu çok iyi tuttuğu halde Na+ iyonu boşluk için küçük, Cs+ iyonu ise büyük gelmektedir.
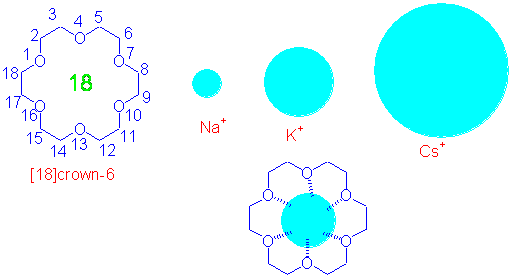
Benzer olarak [15]crown-5 Na+ atomunu, [12]crown-4 ise Li+ atomunu iyi tutabilmektedir. Bu komplexleşme o kadar güçlü dür ki iyonların organik çözücülerde çözünmesini sağlar. Örnek olarak potasyum permanganat (KMnO4) suda çözündüğü halde benzende çözünmez, fakat benzendeki karışımına bir miktar disiklohekzil[18]crown-6 eklendiğinde çözündüğü ve benzeni pembe renge bürüdüğü görülmüştür. Bu kompleksleşme aynı zamanda serbest permanganat iyonları salar ki, organik bir ortamda yükseltgenme için çok uygun bir şarttır.
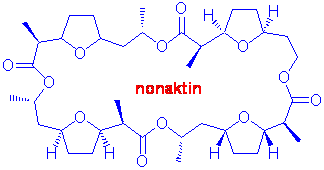
Doğal şartlar içerisinde de makro halkalı bu yapıların kompleksleşmesi çok önemlidir. Nonaktin gibi antibiyotikler, düzenli sıralanmış oksijen atomları içeren boşluklu yapılardır. Nonaktin sodyum (Na+) ve potasyum (K+)nın her ikisinin de bulunduğu bir ortamda sadece K+ iyonlarını yakalayarak, hücre duvarlarından içeriye sızdırır. Bu esnada Na+ iyonlarının geçişi mümkün olmamaktadır.
Problemler
1-Aşağıdaki eterleri hazırlayacak uygun sentezler öneriniz.
![]()
2- Difenil eter sentezinde Williamson sentezi kullanılabilir mi? Nedenini kısaca açıklayınız.
3- Aşağıdaki tepkimeleri tamamlamaya çalışınız. Reaksiyon vermeyenleri de belirtiniz.
a) Dibutil eter + NaOH--------->
b) Metilpropil eter + HBr------>
c) Dipropil eter + Na----------->
d) Dietil eter + H2SO4-------->
4- Etilen oksitle aşağıdaki reaktiflerin tepkimelerini yazınız. a. 1 mol HBr b. (Fazla) HBr c. Fenol + H+
5- 1,1-dimetiloksiran etanolde çözülüp asit ile muamele edildiğinde, sadece 2-metoksi-2-metil-1-propanol oluşmakta 1-metoksi-2-metil-2-propanol oluşmamaktadır. Bu olayın sebebini mekanizma ile açıklayınız.
6- Bromobenzen ve etilen oksit kullanarak 2-feniletanol sentezleyiniz. ( Grignard üzerinden) H+