ALKOLLER, FENOLLER VE TİYOLLER
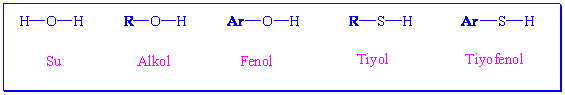
Alkollerin genel formülü R-O-Hdır. Yapısı bir hidrojeni yerine bir alkil grubu geçmiş olan suya benzemektedir. Alkollerin fonksiyonel grubu ( kimyasal özellikleri) hidroksil grubundan kaynaklanmaktadır. Fenoller ise aynı -OH grubuna sahip olmakla birlikte alkil grubu yerine bir aromatik yapı içerirler. Tiyoller, alkoller ve fenollere benzer yapıdadır sadece oksijen yerine periyodik tabloda oksijenin hemen altında olan kükürt bulunmaktadır.
Alkoller, fenoller ve tiyoller doğal yapılarda bulunabilmekle birlikte laboratuarlarda da sentezlenebilmektedirler.
Alkollerin adlandırılması: IUPAC adlandırmasına göre, alkoler -ol son eki ile belirtilir. Alkil grubunun arkasından alkol ekini getirerek kullanımı da oldukça yaygındır.
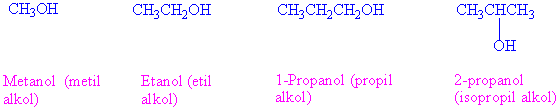
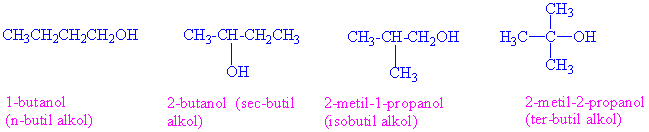
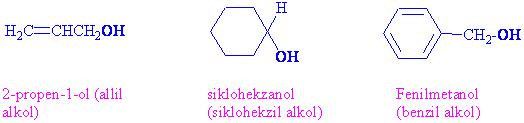
Alkollerin sınıflandırılması
Alkoller hidroksil grubunun bağlı olduğu karbon atomuna bağlı alkil sayısına göre Primer (birincil) (1°), sekonder (ikincil 2°), tersiyer (üçüncül 3°) olarak sınıflandırılırlar.
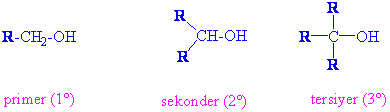
Metil alkol bu sınıflamada bulunmamakla birlikte pirimer alkol olarak kabul edilir.
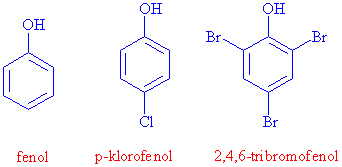
Fenoller genellikle fenolden türetilmiş bileşikler olarak adlandırılırlar
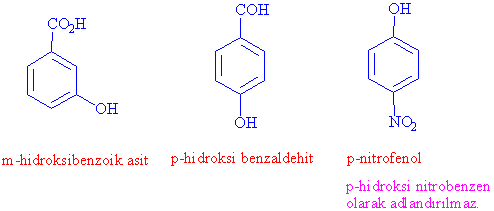
Karboksilik asit, aldehit ve keton grubu bulunduran aromatik yapılarda ise, ilgili fonksiyonel grupların adlandırma öncelikleri bulunduğundan -OH grubu hidroksi olarak adlandırılır.
A/ Aşağıdaki adları verilen bileşiklerin açık formüllerini yazınız.
a) p-etilfenol b) pentaklorofenol (termit kontrolü ve fungusitler için zirai ilaç
c) o-hidroksiasetofenon
Alkollerde ve Fenollerde Hidrojen Bağı
Eğer alkoller, eşit molekül ağırlıklı eterler ve hidrokarbonlarla karşılaştırılırsa, daha yüksek kaynama noktasına sahiptirler.
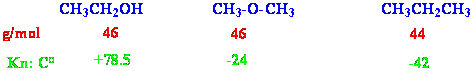
Bunun sebebi alkollerin birbirleri ile hidrojen bağı oluşturmalarıdır. Oksijenin yüksek elektronegativitesi nedeni ile O-H bağı oldukça polarize olmuştur. Bu polarlanma kolayca anlaşılacağı üzere oksijen üzerinde kısmi eksi (-) ve hidrojen atomu üzerinde kısmi artı (+) şeklindedir. Bu polarlanma ve hidrojen atomunun çok küçük olmasından dolayı, pozitif polarlanmış hidrojen atomu başka bir negatif polarlanmış oksijen atomu ile etkileşebilir.
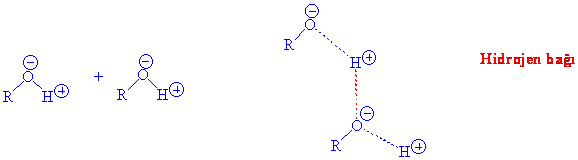
Hidrojen bağı, kovalent bağa göre daha zayıf olmakla beraber, buharlaştırılmak istenen bir molekülde, buharlaşma öncesi kırılması gereken bir bağdır ve hidrojen bağı içeren moleküllerin buharlaşmasında hem hidrojen bağını kıracak hem de buharlaşmayı sağlayacak bir enerji verilmesi gerektiğinden de kaynama noktası beklenenden daha yüksek olmaktadır. Su molekülerinin hidrojen bağı sayesinde, suyun kaynama noktasının beklenenden çok yüksek olması bu durum için verilen en bariz örnektir.
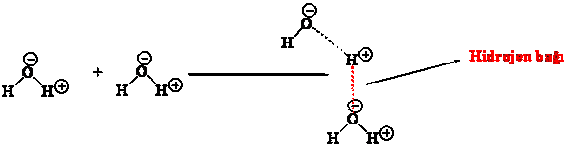
Asitlik ve Bazlık Özellikleri
Her hangi bir organik molekülün asitlik ve bazlığı o molekülün kimyasal özelliklerinin daha rahat anlaşılması için önemlidir. Bronsted-Lowry tanımına göre, asit proton veren ve baz proton alan olarak tanımlanmakta idi.
Örnek olarak, eğer hidroklorik asit suda çözünürse, su hidroklorik asitten bir proton alır ve böylece de baz olarak davranır, HCl ise proton verdiği için asit olarak davranmaktadır.

Bir asitin gücü Ka denen asitlik sabiti ile ölçülür. Ka genelde bir asitin su içerisindeki seyreltik çözeltisinde aşağıdaki gibi hesaplanır.
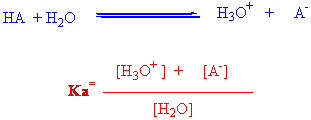
Ka değerinin büyük olması molekülün asitliğinin fazla olması anlamına gelir. Güçlü asitler tamamen iyonlaşabildikleri için , denge sabiti yazılamayabilir.
Su molekülü kendi içerisinde de belli bir oranda iyonlaşmaktadır, bu durumda ki Kası ise
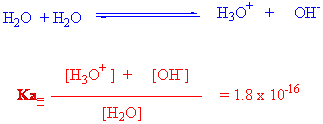
kadardır.
Negatif üstel değerli ( çok çok küçük) Ka değerlerini daha anlaşılır ve basit şekilde ifade etmede pKa denen asitlik sabiti Kanın negatif logaritması kullanılır.
Örnek olarak suyun pKası= - log (1.8 x 10 -16) = - log 1.8 - log10 -16 = -0.26 + 16 =15.74
pKa ve Kanın matematiksel ifadelerinde, Küçük Ka değerleri yada büyük pKa değerleri zayıf asitleri ifade etmektedir.
Bir asitin ğücü ile, konjuge bazının gücü arasında ters bir ilişki olduğunun hatırda tutulması çok önemlidir.
İkinci önemli asit baz tanımlaması ise Lewis tanımıdır ki, elektron çifti alabilen maddeler Levis asiti ve elektron çifti verebilen maddelere ise Levis bazı denmektedir.
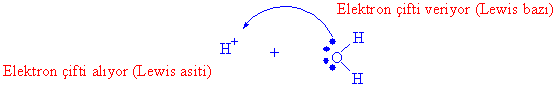
Üzerinde elektron çifti bulunan herhangi bir madde, Lewis bazı olarak, üzerinde boş orbital ( elektron boşluğu bulunan madde de Lewis asiti olarak davranır. Genelde kimyasal reaksiyonlarda AlCl3, FeCl3 Lewis asiti olarak kullanılan maddelerdir.
S/ Elektron dagılımlarını yazarak, Al+3 ve Fe+3ün neden Lewis asiti olarak davrandığını açıklayınız.
Bir maddenin asitliği yada bazlığı ancak bir başka madde ile karşılaştırılarak söylenebilir. Genelde bu karşılaştırma su ile yapılırken, bazı maddeler güçlü asitler karşısında baz, güçlü bazlar karşı sında asit olarak davranırlar. Örnek olarak su molekülü, süfirik asit karşısında baz, amonyak karşısında asit olarak davranır.
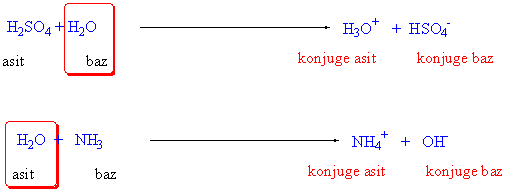
Kendinden güçlü asitlere karşı baz, kendinden güçlü bazlara karşı asit olarak davranan bu tür bileşiklere amfoter bileşikler bu özelliğe de amfoterik özellik denir.
Alkoller ve fenollerin asitlikleri
Alkollerde ve fenollerde su gibi zayıf asittirler. -OH gurubundan bir proton vererek ayrışır.
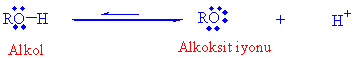
İyonlaşma sonucu oluşan konjuge baz, alkoksit iyonu olarak adlandırılır. Eğer alkoller zayıf birer asit iseler bunların konjuge bazları, alkoksitler ( metanolden -metoksit, etanolden etoksit, propanolden propoksit) güçlü bazlar olmalıdır. Aşağıda bazı alkollerin pKa değerleri verilmiştir.
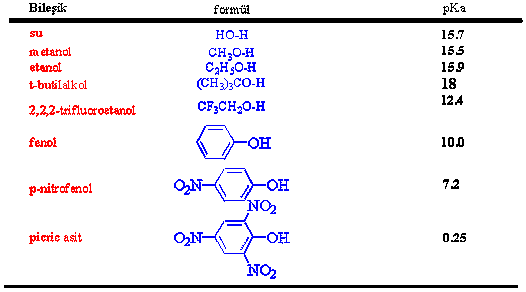
Tablodan da rahatça görüleceği gibi fenoller, alkollerden daha güçlü asittirler. Bu durumu nasıl açıklayabiliriz ?
Fenollerin, alkollerden daha asidik davranmasının temel sebebi, fenoksit iyonu üzerindeki negatif yük delokalizasyonla (konjugasyon) daha kararlı hale gelmekte ve oluşumu kolaylaşmaktadır.
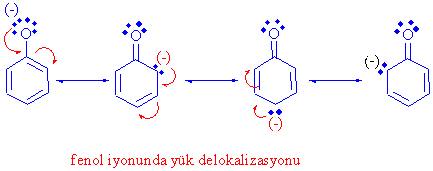
Alkollerde bu delokalizasyon mümkün olmamaktadır.
Konjugasyon kadar etkili olmamakla birlikte, -OH grubunun bağlı bulunduğu karbon atomunun sp2 hibriti yapmış olması da asitliğini belli ölçüde artırmaktadır. Alkollerde -OH grubunun bağlı bulunduğu atomun sp3 hibriti yapmış olduğuna da dikkat ediniz.
Trifloro etanoldeki asitliğin etanole göre oldukça fazla olmasının sebebini açıklanmak için ise, indüktif etki denen kimyasal olayı bilmemiz gerekmektedir.
Flor oldukça elektronegatif bir atomdur ve elektronegatifliği daha düşük olan, bağlı bulunduğu karbon atomundan elektron çekmektedir. Böylece ilgili karbon atomu kısmen pozitif yüklenir ki bu da oksijen üzerindeki negatif yüke komşu durumda olduğundan, eksi yükü kararlı kılar. (Negatif yükün kararlı kılınmasının asitliği artırdığını hatırlayınız).
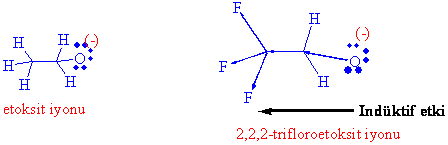
Burada florun asitliği artırması, sadece flor atomuna has bir özellik olmayıp, tüm elektron çekici gruplar bağlandıkları asitlerin konjuge bazını kararlı kıldıkları için asitlik gücünü artırır ve tüm elektron verici gruplar ise konjuge bazı destabilize ettiğinden asitliği azaltıcı yönde bir etki gösterirler.
Konjugasyonda oluşan iyonu kararlı kıldığından, konjugasyona girebilen substituentler ise asitliği elektron çekenlere göre daha fazla artırırlar.
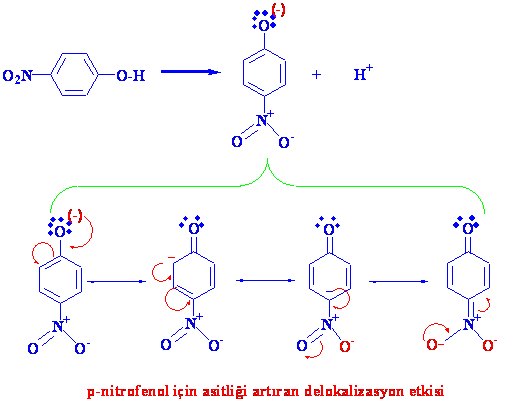
Nitro grubu için, öncelikle azot pozitif yüklü olduğundan elektron çekici bir etkisinin olacağı göz önündedir. İkinci olarakta benzen halkası üzerindeki negatif yük rezonansına nitro grubunun da katılması ile, oluşan fenoksit iyonu oldukça kararlı kılınmaya başlanmış olur ki bu iki etken nitrofenolün pKasını 10dan 7.2ye düşürür (tablo) .
A/ 2,4-dinitrofenol içinde benzer çalışmayı siz yapınız.
A/ Aşagıdaki molekülleri artan asitlik sırasına göre sıralamaya çalışınız.
a) 2-kloroetanol b) p-klorofenol c) p-metilfenol
d) etanol e) fenol
Alkoksitler -OH iyonu gibi oldukça güçlü bazdırlar, genelde organik sentezlerde baz olarak alkoksitler kullanılır (EtO- çokca). Alkoksitler, alkollerin sodyum veya potasyum metali ile direk yada bir metalhidrit ( eksi yüklü hidrojen) reaksiyonundan kolayca elde edilebilirler. Bu reaksiyon dönüşümsüz olarak yürüyerek metal oksitleri vermekte ve beyaz kristaller halinde izole edilebilmektedir.

Alkoller ve fenollerin bazlığı
Alkoller ve asitler zayıf asit oldukları gibi zayıf baz olarak da davranırlar ( amfoter tanımını hatırlayınız). Oksijen üzerinde elektron çifti bulundurduklarından ortamdan proton tutabilirler ve sudaki hidronyum (H3O+) iyonu gibi alkil okzonyum iyonu oluştururlar.

Alkollerin alkenlere dehidrasyonu (su ayrılması)
Alkoller kuvvetli asitlerle ısıtıldıklarında su kaybederler (dehidratize olurlar). Örneğin etil alkolü sülfürik asitle ısıtmak eten verir.

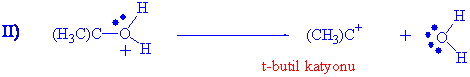
Bu tür reaksiyonları E1 ve E2 eliminasyon reaksiyonlarında kısaca açıklamıştık. Alkollerin dehidrasyonu her iki mekanizma üzerinden de yürüyebilir. t-Butilalkolün eliminasyonu incelersek eliminasyonun birinci basamağında daima hidroksil grubu protonlanır.
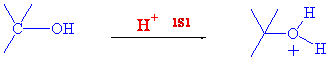
Su molekülünün ayrılması, hem kararlı bir ayrılan grup hem de oldukça kararlı bir karbokatyon olan t-butil katyonunu verir.

Pozitif yüke komşu bir hidrojenin s-bağ elektronları pozitif yükün bulunduğu yerdeki p-orbitaline kayar ve bir proton ayrılması ile reaksiyon tamamlanmış olur.
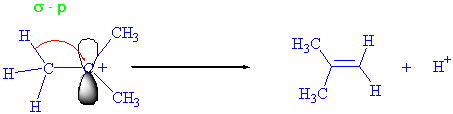
Primer alkollerde, karbokatyon kararlılığının yeterli olmadığını ve bu reaksiyonda suyun ve protonun aynı anda ayrılmasının daha uygun olacağını anlamaya çalışınız.
Aşağıdaki etanolün dehitrasyonu sizlere biraz daha kolaylık sağlayacaktır.
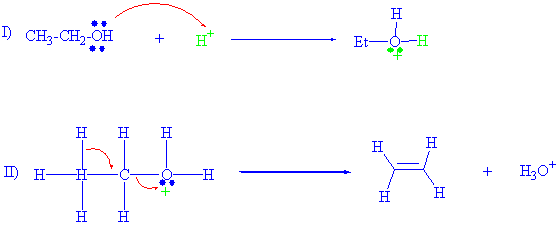
Alkollerden su ayrılmasında dikkat edilmesi gereken, ilk basamak olarak daima alkolün öncelikle bir baz olarak davranması ve ortamdan bir proton almasıdır. Reaksiyon başladığında tersiyer alkollerin kolayca su kaybettiği, sekonderlerde primerden daha hızlı tersiyerden daha yavaş elimine olması, primerlerde ise kararlı karbokatyon oluşturamadığından, daha yavaş ve proton ile suyun aynı anda ayrılmasıdır.
Alkil halojenürlerden de hatırlanacağı üzere bazen alkoller eliminasyon sonunda iki eliminasyon ürünü verebilirler. Burada da oluşan karbokatyona komşu iki farklı elimine olabilecek hidrojen atomu bulunduğuna dikkat ediniz.
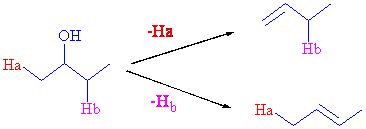
Hbnin elimine olduğu Hanın ise molekülde kaldığı, ürünün çift bağ etrafında daha fazla alkil grubu içermesinden dolayı daha kararlı olması, bu ürünün de daha fazla oluşması anlamına gelir.
A/ Aşağıda verilen moleküllerin asidik eliminasyonu için mümkün tüm ürünleri yazıp hangi ürünün daha fazla olacağını tartışınız..
Alkollerin Halojen Asitleri ile Reaksiyonları
Alkoller halojen asitleri ile alkil halojenürleri vermek üzere reaksiyona girerler.
![]()
Bir önceki konumuzda alkollerin asitlerle su kaybı ile alkenleri verdiklerini görmüştük. Halojen asitlerinde, halojenlerin küçük yapılı ve güçlü nükleofil olmalarından dolayı eliminasyondan daha fazla yer değiştirme reaksiyonu yürür. Böylece alkenler yerine alkil halojenürler elde edilir. Reaksiyonun hızı alkolün tersiyer, sekonder yada primer olmasına göre değişir.
Tersiyer alkoller en hızlı, primerler ise en yavaş yürüyenidir. Tersiyer bütil alkol oda sıcaklığında derişik hidroklorik asitle birkaç dakika çalkalama sonucu elde edilebilir.

Mekanizmada, alkolün protonlanması ve su molekülünün ayrılması aynen yürümekle beraber, karbokatyona komşu bir hidrojen ayrılmadan önce halojen nükleofil olarak atak yapar ve karbokatyona bağlanır.
I)
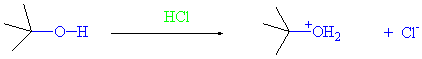
t-butil alkol

Primer alkollerde reaksiyonlar ise bazen saatlerce ısıtılarak ve ZnCl2 gibi bir katalizör yardımı ile beraber yürüyebilmektedir.
Alkil halojenürleri alkollerden hazırlamanın başka yöntemleri de vardır. Örnegin, tiyonilklorür (SOCl2) alkollerle reaksiyonu sonucu alkil klorürleri oluşturur.
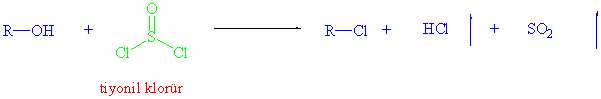
Yukarıdaki reaksiyondan da anlaşılacağı üzere, reaksiyon ürünleri hidroklorik asit gazı ve kükürt dioksit gazıdır ki ortamdan kolayca uzaklaşırlar.
Fosfor halojenürleri de (PXn) alkolleri alkil halojenürlere dönüştürmektedirler.

A/ Aşağıda verilen alkil halojenürleri, alkollerinden hazırlama denklemlerini yazınız.

Alkoller ve Fenollerin Karşılaştırılması
Alkoller ve fenoller benzer fonksiyonel gruba sahip olduklarından bir çok benzer özelliklere sahiptirler, fakat alkollerde C-OH grubunu asit katalizi ile ayırmak oldukça kolay olmasına rağmen, fenollerde bu bağı kırmak oldukça zordur. Normalde fenoldeki -OH grubunun protonlanması mümkündür,
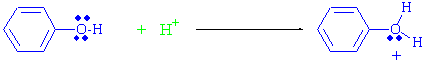
fakat suyun molekülden ayrılmasının fenil katyonu vermesi gerekmektedir ki;

fenil grubu sp hibriti yapmış bir karbokatyona sahiptir. sp hibritinin dogrusal olma durumunda açısının 180° olduğu hatırlanırsa, bunun fenil katyonu için mümkün olmayacağı kolayca anlaşılabilir. Bu durumdan dolayı fenol SN1 mekanizması gereği veya SN2 mekanizması ile yer değiştirme reaksiyonu da veremez. Yani fenollerle, alkol grubu halojen asitleri, fosforhalojenürleri ve tiyonilklorürlerle reaksiyon vermez.
Alkollerin aldehit keton ve kaboksilik asitlere yükseltgenmeleri
Hidroksil grubunun bağlı olduğu karbon atomuna en az bir tane hidrojen bağlı bulunan alkoller karbonil bileşiklerine yükseltgenebilirler. Bunun anlamı primer ve sekonder alkoller yükseltgenme reaksiyonu verirken, tersiyer alkoller bu reaksiyonu veremezler.
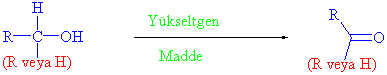
Pirimer alkoller, birinci yükseltgenme sonucu aldehit ve ikinci yükseltgenmede karboksilik asitleri verirler.
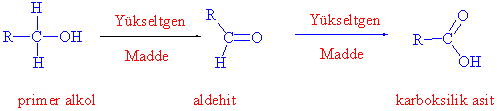
Sekonder alkoller ise sadece ketonlara yükseltgenirler.

Tersiyer alkoller yükseltgenme için şart olan hidroksilin bağlı bulunduğu karbon atomunda hidrojen atomunu içermediğinden yükseltgene ürünü vermezler.
Yükseltgen madde olarak genelde laboratuarlarda Jones reaktifi denen CrO3 ün sülfürik asitli asetonda çözünmüş çözeltisi kullanılır.
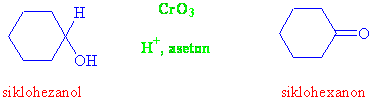
Sekonder alkoller sadece ketona kadar yükseltgenebildiği için başka ürün olmamakla birlikte, primer alkollerin birinci basamakta aldehitlere, ikinci basamakta da karboksilli asitlere dönüştüğünü görmüştük. Bir primer alkolü, karboksilik asit basamağına gelmeden aldehit basamağında durdurmak istediğimizde, ilgili aldehiti nasıl hazırlayabiliriz ?
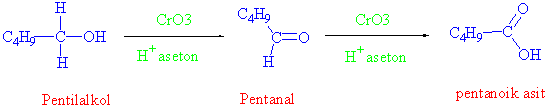
Yükseltgen olarak eğer sadece CrO3 (krom anhitridi) kullanılırsa reaksiyon aldehit basamağında durmaz, karboksilli asite kadar yükseltgenir. Fakat CrO3ten PCC (pridinyum klorokromat) hazırlanır ve bu reaktif kullanılırsa, primer alkoller sadece aldehitlere kadar yükseltgenebilirler.
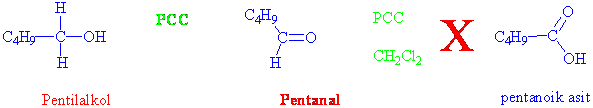
PCC, kromik anhitridin HCl de çözünmesi ve piridin ilavesi ile hazırlanır.
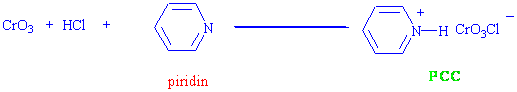
Birden fazla -OH grubu içeren alkoller
Birbirine komşu iki -OH grubu içeren alkollere glikoller denir ve en önemli bileşiği ise etilen glikoldür. İkiden fazla hidroksil grubu içeren bir çok alkolde bilinmektedir. Bunlardan kimyasal açıdan önemli bazıları gliserol ve sorbitoldür.
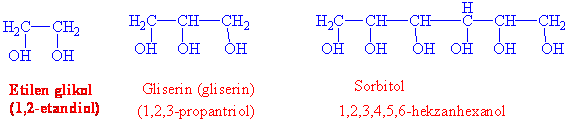
Etilen glikol arabalarda antifiriz olarak kullanılır. Etilen glikolün kaynama noktası etanol ile karşılaştırıldığında oldukça yüksektir, bunun sebebi hidrojen bağı yapma kapasitesinin daha fazla olmasıdır.
Gliserol tatlı bir madde olup, losyon ve lavabo sabunlarında kullanıldığı gibi, öksürük şuruplarında da tatlandırıcı olarak kullanılmaktadır. Tütünlerde nemlendirici madde olarak da kullanılmaktadır.
Gliserinin nitrolanması sonucu nitrogliserin oluşur ki, çok güçlü bir patlayıcıdır. En hafif titreşimle dahi patlar.
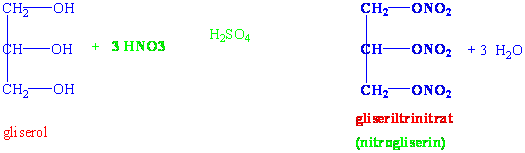
Nitrogliserin anjiyodan zorluk çeken kalp hastalarında damar açıcı olarak da kullanılmaktadır. Gliserolün tri-esterleri ise yağlar olarak adlandırılmaktadır.

Fenollerde aromatik substitüsyon (yer değiştirme) reaksiyonları
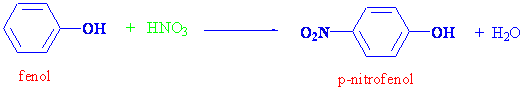
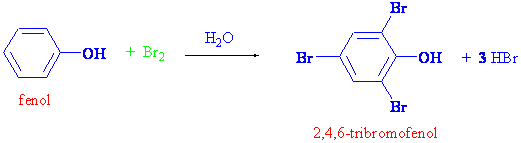
Daha önce alkollerin verip fenollerin vermediği bazı reaksiyonlardan bahsetmiştik. Fenollerin verip alkollerin vermediği bazı reaksiyonlarda vardır. Fenollerde -OH grubunun sıkı bir şekilde bağlı olduğunu ve genelde -OH üzerinden reaksiyon vermediğini anlatmıştık. -OH grubu güçlü bir halka aktifleyicisi olduğundan, aromatik yapıdaki hidrojen atomlarından bazılarının yer değiştirme reaksiyonu vermesini kolaylaştırır. Örnek olarak fenoller nitrik asitle nitrolama reaksiyonu, broml ile de kolayca bromlama ürünü 2,4,6-tribromo fenol verirler.
Fenolllerin yükseltgenme reaksiyonları
Fenoller genelde kolayca yükseltgenebilen maddelerdir. Örnek olarak 1,4-dihidroksibenzen (hidrokinon) açık havada dahi zamanla kinona yükseltgenir. Yükseltgenme sonucu çok renkli bileşikler verir.
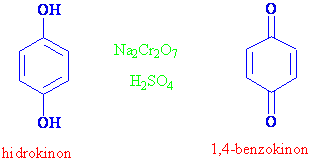
Hidrokinon ve benzeri bileşikler fotoğraf baskısında çokça kullanılmaktadır. Kinon -hidrokinon dönüşümlü bir tepkime olduğundan, bir çok yükseltgenme indirgenme olayında yararlanılan maddelerdir.
Bazı fenol bileşikleri, açık havadan bozunan yiyeceklerin korunmasında da kullanılmaktadır. Genelde yiyeceklerin bozunması kimyada yükseltgenme ürünlerine dönüşmesi olarak bilinir. Eğer ortamda gıdadan daha kolay bir yükseltgenen bir madde bulunursa bu madde öncelikle yükseltgeneceginden bozunmanın suresini yavaşlatacaktır. Örnek olarak BHA denilen butillenmiş anisol ve BHT denilen butillenmiş hidrotoluen bu tür kullanılan maddelerdir.
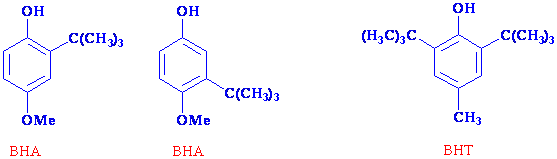
BHA genelde et türevlerinin korunmasında, BHT ise gıdaların korunmasında çokça kullanılmaktadır.
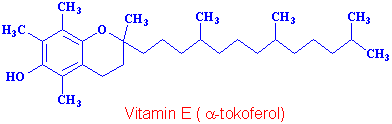
Vitamin E de tabiatta kendiliğinden oluşan bir koruyucu maddedir.
TİYOLLER (fenoller ve alkollerin kükürt türevleri)
Kükürt periyodik cetvelde hemen oksijenin altında bulunmakta ve organik moleküllerin yapılarında bulunabilen hetero-atomlar dediğimiz atomlar içerisindedir. -SH grubu sülfüril grubu fonksiyonel grup olarak da tiyoller olarak adlandırılır.
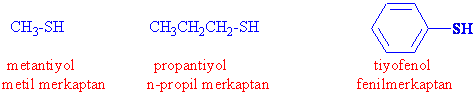
Tiyollerin merkaptanlar olarak da adlandırılmasının sebebi, civa ( merküri) iyonları ile merkaptid denilen ürünleri vermesinden kaynaklanmaktadır.

Tiyoller bir çok açıdan alkollere benzemesi nedeni ile detaylı anlatılmamıştır, sadece kükürt atomunun elektron çiftlerinin oksijen atomuna kıyasla daha uzun olmasının akılda tutulması önemlidir.