ORGANİK HALOJEN BILEŞİKLERİ:
SUBSTİTÜSYON (Yer değiştirme) ve ELİMİNASYON (Ayrılma)
Alkil halojenürler, organik kimyada önemli bir yer tutar. Bazı klor ve brom bileşikleri tabii olmakla birlikte bir çok organik halojen bileşikleri laboratuarlarda sentezlenmiştir. Daha önceleri de kısaca açıkladığımız gibi organik halojen bileşikleri, bir hidrojen ve bir halojen kaybı ile alkenlerin hazırlanmasında, substitüsyon ile bir çok fonksiyonel grubun hazırlanmasında, sentetik anlamda kullandığı gibi, bazı çoklu halojen bileşikleri de, kozmetik sanayisinde, böcek ilaçlarında, temizlik sıvılarında, soğutucu gaz olarak buzdolaplarında kullanılmaktadır. Bu bölümde alkil halojenürlerin bazı özel reaksiyonlarından bahsedeceğiz.
Nükleofilik substitüsyon ( Nükleofilik yer değiştirme) reaksiyonları
Alkil halojenürler nükleofiller ile yer değiştirme tepkimeleri verirler. Örnek olarak, etil bromür OH- iyonu ile tepkimesi sonucu etil alkolü verir.
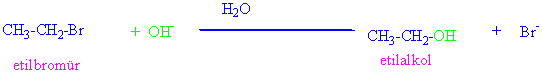
Bu reaksiyonda, reaksiyon verecek madde etil bromür substrat, reaksiyonu başlatan kısım OH- nükleofil, -Br ayrılan grup ve etil alkol ise ürün olarak adlandırılır.
Reaksiyonda nükleofil ayrılan grup ile yer değiştirmiş olduğundan genel olarak bu reaksiyonlar Nükleofilik Sübstitüsyon (SN-) reaksiyonu olarak adlandırılır.
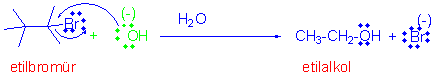
Reaksiyona dikkatlice bakıldığında bir kovalent bağın kırıldığını (C-Br ) bir yeni kovalent bağın ise oluştuğunu (C-O) görürüz. Bu durum kısaca aşağıdaki gibi formülize edilir.


Nükleofil negatif yüklü olabileceği gibi, yüksüz ama elektron çifti bulunduran maddeler de olabileceğine dikkat ediniz.
Eğer nükleofil yüksüz ise, ürün pozitif yüklü, nükleofil negatif yüklü ise ürünün yüksüz olur. Bunun sebebi ayrılan grubun bağ elektronlarını alarak ayrılması ve substratta bir pozitif yük bırakmasıdır. Bu yük olduğu gibi kalır yada negatif yükle nötrleştirilir.
Yer değiştirme reaksiyonuna dikkatlice bakılırsa, ayrılan grubun üzerinde de elektron çifti bulunduğu ve kendisinin de aslında bir nükleofil görevi görebileceği açıktır. Bu durum aslında reaksiyonun çift yönlü olabileceğini göstermektedir. Tepkimenin daima sağa doğru (ürün yönünde) gitmesinin tek yolu nükleofilin ayrılan gruptan oldukça güçlü olmasıdır. Örnek olarak alkilbromur ve hidroksil yer değiştirmesinde hidroksil grubu brom iyonuna göre daha güçlü nükleofildir ve yerdegiştirme kolayca ve hızlıca alkol tarafına yürür.
Nükleofiller genelde, oksijen, azot, kükürt, halojen ve karbon nükleofilleri olarak karşımıza çıkar.
S / Sodyum etoksit ve etil bromürün vereceği yer değiştirme tepkimesini yazıp maddeleri sınıflandırınız.
![]()
Reaksiyonda etoksit nükleofil, etilbromür substrat ve dietileter üründür.
Alkil halojenürlerin nükleofiller ile yer değiştirme reaksiyonları her zaman aynı mekanizma üzerinden yürümez. Alkil grubuna, özellikle de halojenin bağlı olduğu karbon atomundaki alkil grupları ve sayıları, özellikleri tepkimenin şeklini değişmektedir. Bir kaç örnekle bu durumu inceleyelim.
![]()
n-Butil klorürün siyanür nükleofili ile reaksiyonu sonucu butil siyanür oluşur. Aynı reaksiyon t-bütil bromür ile denenir ise yer değiştirme ürünü yerine ayrılma ürünü oluşur.
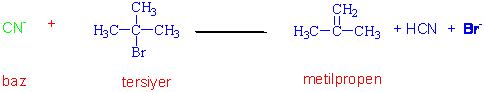
Bu değişik durumların anlaşılmasında reaksiyon mekanizması kavramının anlaşılması çok önemlidir.
Nükleofilik yer değiştirme reaksiyon mekanizmaları
Nükleofilik yer değiştirme tepkimeleri birden çok yol izleyebilmektedirler. Bu mekanizmaların genel olarak bilinmesi gereken bazıları burada kısaca anlatılacaktır.
İki ana nükleofilik yer değiştirme tepkimesi vardır. Bunlar SN1 ve SN2 olarak adlandırılan (nükleofilik Substitüsyon 1 ve Nükleofilik Sübstitüsyon 2, tepkimelerdir ki, izlenilen yolların birbirinden farklı olduğu anlamına gelir.
SN2 mekanizması bir basamakta yürür, bunun anlamı reaksiyonda, nükleofilin bağlanması ve bir grubun ayrılması aynı zamanda meydana gelir.

SN2 mekanizmasında izlenen yol kısaca şöyle özetlenebilir. Nükleofil, üzerinde bulunan elektron çiftleri veya negatif yükle (ki aynı anlama gelir), C-L bağına arka taraftan saldırır, böylece bir tek orbitalinde bulunan iki elektronunu kısmen pozitif yüklü karbon atomu ile ortaklaşa kullanma çabasındadır. Karbon atomunun orbital yapısı beşli bağ yapmaya müsait olmadığından, nükleofilin verdiği elektron çifti ve ayrılacak olan grubun elektron çiftini kabul etmede tereddüt eder ki bu an geçiş durumu olarak adlandırılır. Bu noktada C-atomu her ne kadar 5 bağ yapmış gibi gözükse de, aslında tercih yapma anında tereddüt halindedir ve daha güçlü elektron verici olanı tercih edecektir. Nü nükleofil adı gereği (çekirdek seven) elektron vermede daha güçlü davranacak ve karbon atomuna bağlanacak, ayrılan grup ise daha önce karbon atomu ile paylaştığı elektronlarını alarak (negatif) uzaklaşacaktır.
Mekanizmada, substrat ve ürünün stereo kimyasına dikkatlice bakıldığında, konformasyonun ters çevrildiğini (R den S veya S ten R) anlamak kolay olacaktır. Her bir SN2 tepkimesi sonucu konformasyonda bir değişiklik olma zorunluluğunu tartışınız ?
SN2 deki 2 rakamı reaksiyonun bimoleküler (Nükleofil ve substratın aynı anda reaksiyon vermesi) olduğunu gösterir. Buda reaksiyonun hızının hem nükleofile hem de substrata (başlangıç maddesi) bağlı olarak ikinci dereceden bir reaksiyon olduğunu anlamına gelir.
SN2 tepkimesi için bazı özellikler aşağıdaki örnekle açıklanmaya çalışılmıştır.
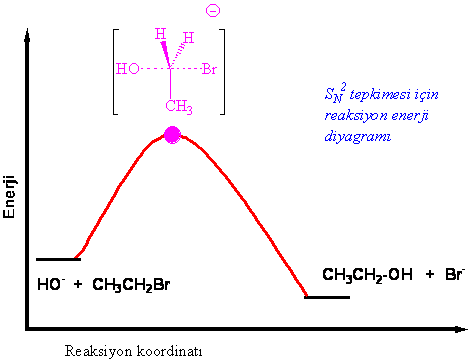
Reaksiyonun ikinci dereceden olması nükleofil ( HO-) yada başlangıç maddesi ( CH3CH2Br) nin konsantrasyonunun iki katına çıkartılması ile reaksiyon hızının iki katına çıkacağının ifadesidir.
Bu tepkimede de başlangıç maddesinde halojenin bağlı olduğu karbon atomunun iki hidrojen atomu içermesinden dolayı konfigürasyondan bahsedemeyiz, bunun için kiral moleküllerdeki bu dönüşümü (Çevrilme- Devrilme) de bir örnekle incelemeye çalışalım.
A/ (R)-2-bromobutanın sodyum hidroksitle reaksiyonunu mekanistik olarak inceleyiniz.
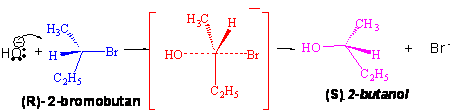
Burada R alkil halojenürden S alkol elde edilişini daha önce açıklanan özellikle bağdaştırınız.
SN2 tepkimelerinde reaksiyon hızı alkil grupları küçüldükçe artarken büyüdükçe azalır. SN2 Hız ; pirimer >sekonder>tersiyer. Bunun sebebi nüklefilin yaklaşabileceği bölgenin daralması ve atak yapmaya zorluk çıkması olarak açıklanabilir. Bu durum daha görsel olması açısından aşağıda şematik olarak ifade edilmeye çalışılmıştır.
![]()
 ????
????
Şekilden de kolayca görüleceği gibi nükleofil iki küçük atom olan hidrojenlerin arasındaki boşluktan karbon atomunun karşıt bağına daha kolay yaklaşabilmektedir.

Substitüsyona ugrayacak olan grubun baglı bulunduğu karbon atomuna ulaşmak biraz daha zorlaşmıştır. iki alkil grubu açık olarak düşünüldügünde, yaklaşılacak boşluğun sadaca küçük atom hidrojene yakın olan bölgeler oldugu görülür.

Karbon atomuna üç alkil grubunun bağlanması, nükleofilin yaklaşacağı boşluğu nerede ise yok etmiştir. Alkil grubunun ve nükleofilin büyüklüğüne de bağlı olarak bu reaksiyon çok çok yavaş yada hiç yürümemektedir.
SN1 mekanizması;
İki basamaklı yürüyen bir tepkime mekanizmasıdır. Birinci basamağında SN2 de olmayan, C-L bağının kırılması ve bir karbokatyon oluşumu vardır ki, bu basamak oldukça yavaş yürür.
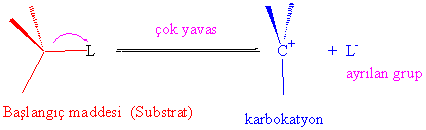
Karbokatyon oluşumu ayrılan grubun bağ elektronlarını beraberinde alması anlamına gelir ve bundan dolayı da ayrılan grup genelde negatif yüklüdür.
Tepkimenin ikinci basamağında, üzerinde elektron çifti bulunduran nükleofil oluşan karbokatyona atak yapar ki bu basamak oldukça hızlı yürüyen bir basamaktır.
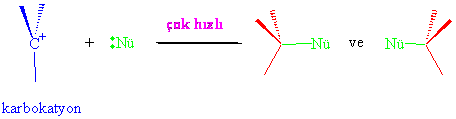
Nükleofil negatif yüklü ise direk ürün oluşur. Eğer nükleofil yüksüz bir molekülün, elektron çiftleri olarak atak yapmışsa, genelde bir proton kaybı ile nötr molekül ( ürün ) elde edilir.
Örnek olarak, t-butilbromürün sodyum hidroksitle reaksiyonunu ele alacak olursak;
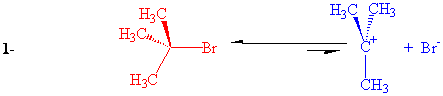
Birinci basamak sonucu oluşan tersiyer butil karbokatyonu, elektron verici olan üç alkil tarafından kısmen kararlı hale getirilmiştir. (hiper konjugasyon etkisi)
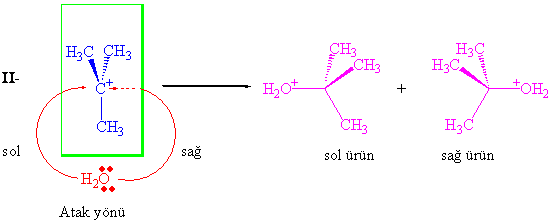
İkinci basamakta, oluşan karbokatyon düzlemsel olduğu için , nükleofilin her iki tarafından da saldırması mümkündür. Bu durumun iki tür ürün vermeye sebep olabileceğini göz ardı etmemek gerekir. Eğer bir stereojenik ( optikçe aktif ) karbon atomu ile başlanırsa oluşan ürün SN2nin tersine bir karışım olacak ve optikçe aktiflik kaybolacaktır (Rasemik karışım). Nükleofil yüksüz bir molekül olan su molekülünün elektron çifti olduğundan bir ara ürün oluşacaktır.
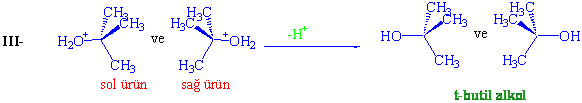
Üçüncü basamakta, ikinci basamaktan oluşan pozitif yüklü ara ürün kararsız olduğu için bir proton kaybederek en kararlı hali olan t-butil alkole dönüşmüş olur.
SN1 mekanizmasına göre enerji diyağramı da SN2 mekanizmasındaki enerji diyagramından daha farklı olacaktır.
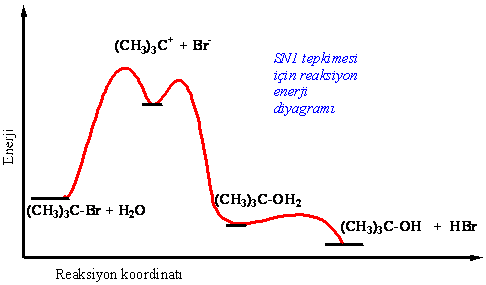
Her bir aşamayı ve kararlılığını enerji diyagramı yardımı ile tartışınız.
SN1 mekanizmasında rasemleşmeye bir örnek verecek olursak;
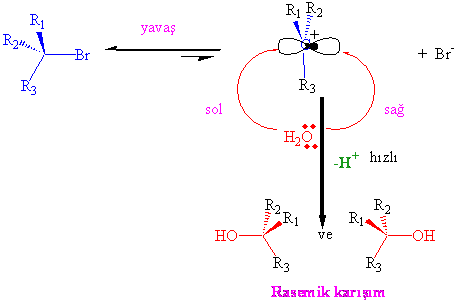
A/ R1, R2, R3ün sırası ile metil, etil ve propil olması durumunu sizler inceleyiniz.
SN1 mekanizması ise SN2nin tersine tersiyer >sekonder >primer şeklinde yürür, bunun sebebini de, sizler SN2de yapılan açıklamaya bakarak, yine atak yapabilecek boşluğa bağlı olarak açıklamaya çalışınız.
SN1 ve SN2 mekanizmalarının karşılaştırılması.
Verilen bir başlangıç maddesi ve nükleofile bakarak, bunun SN1mi yoksa SN2 mekanizması üzerinden mi yürüyeceğine karar vermek bazen güç olabilir. Substitüentlerin etkilerine bakıldığında; aslında bu iki mekanizmanın da bir çok yer değiştirme mekanizmasında aynı anda yürüdüğünü, fakat birinin tercihli olduğunu söyleyebiliriz. Bu tercih, tesiyer olanlarda SN1 mekanizması üzerinden primer olanlarda ise SN2 üzerinden yürüyecek şeklinde genellenebilir. Sekonder, olanlarda ise her ikisi üzerinden de aynı anda yürüyebileceği için kararız biraz daha zor olduğu, çözücü ve nükleofilin yapısına bağlı olarak her hangi birine doğru yönlendirilebilir olduğu akılda bulundurulmalıdır.
Bir reaksiyonun mekanizmasının bilinmesi, istenen ürüne ulaşmak özelliklede stereo kimyasal ürünlere ulaşmak açısından çok büyük önem arz etmektedir. SN2 üzerinden yürüyenlerin konformasyonlarının dönüştüğünü, SN1 üzerinden yürüyenlerde ise genelde rasemleşme gözüktüğünü anlatmıştık.
Su ve alkol gibi polar protik çözücüler, SN1 mekanizmasında oluşan karbokatyonu ve halojen iyonunu çevreleyerek daha kararlı hale getirdiklerinden, reaksiyonun yönünü SN1e, apolar çözücüler ise, SN2 mekanizmasında nükleofilin elektron çiftleri ile etkileşmediklerinden, daha rahat atak yapma imkanı sağlamaları nedeni ile, SN2 yönüne kaydırırlar. Böylece sekonder bir alkil halojenürün solventle belli oranda yönlendirilmesi söz konusu olabilir.
Bu yönlendirilebilme durumunu bir örnekle incelemeye çalışalım.
A/ (R)-2-iyodobutanın %95lik aseton ve %5lik su karışımındaki reaksiyonu hemen hemen tamamen (S)-2butanol verirken, %30 aseton %70 su karışımındaki reaksiyonu sonucu % 60 (S)-butanol ve %40 (R)-2-butanol elde edilmektedir.
Öncelikle SN2 mekanizmasını bir inceleyelim
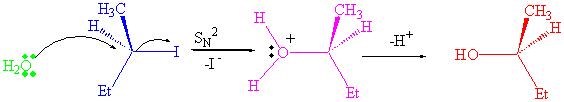
Su molekülleri çözücü olmadan çok nükleofil olarak davranırlar. Suyun artırılması ise, suyun çözücü olarak da davranmaya başlamasına yani polarlığın artmasına sebep olur ki SN1 sonucu oluşacak iyonlar koordine edilerek biraz daha kararlı hale getirilebilir.
Nükleofiller de mekanizmalarda belirleyici olabilirler. Hacimce küçük ve negatif yüklü nükleofiller genelde SN2 mekanizmasını tercih ederken, hacimce büyük ve yüksüz moleküller genelde SN1 mekanizmasını tercih edeceklerdir.
ALKİL HALOJENÜRLERDEN HİDROHALOJEN AYRILMASI-ELİMİNASYON
Eliminasyon reaksiyonları, daha önceden kısaca aşina olduğumuz bir reaksiyon türüdür, büyük bir molekülden küçük bir grubun ayrılması ve ayrılma olan iki atom arasında çift bağ oluşumu olarak tanımlanmıştı. Nükleofilik yer değiştirme reaksiyonlarında kullanılan nükleofiller, baz olarak da kullanılan maddeler olduğundan, reaksiyonda nükleofil olarak bir pozitif çekirdeğe atak yapabileceği gibi, baz olarak davranarak, molekülden bir proton da koparmaya çalışabilir. Bu durumda bir birinden tamamen bağımsız iki farklı reaksiyon oluşur ki bunlardan biri, yerdegiştirme (sübstitusyon) diğeri ise ayrılma (eliminasyon) reaksiyonu olarak karşımıza çıkar.
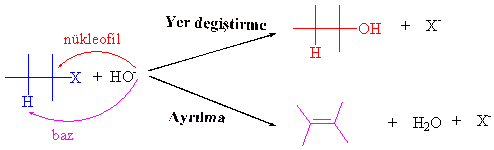
Eliminasyonun olabilmesi için halojenin bağlı bulunduğu karbon atomuna komşu karbon atomunun en az bir hidrojen atomu içermesi zorunludur. Yukarıdaki denklemlerden de kolayca anlaşıldığı üzere yer değiştirme reaksiyonunda nükleofil halojen ile yer değiştirmiştir.
Ayrılma tepkimesinde ise, baz ayrılacak halojene komşu konumda olan bir hidrojeni kopararak iki karbon atomu arasına bir çift bağ oluşmasına sebep olmuştur. Eliminasyon reaksiyonları kısaca E ifadesi ile gösterilir. Bu reaksiyonlar sentetik anlamda ikili ve üçlü bağların oluşumu amacı ile kullanılan bir yöntemdir. Ayrılma tepkimelerinde yaygın olan ve bilinen iki tür vardır, bunlar E2 ve E1dir.
Farklı eliminasyonun ifadelerinin aslında farklı mekanizma anlamına geldiği artık kolayca anlaşılıyor olmalıdır. Bu mekanizmaları şimdi detaylıca irdelemeye çalışalım.
SN reaksiyonları ile karşılaştırmak açısından, E2 mekanizması da bir basamakta yürüyen bir tepkimedir.
E2 mekanizması, nükleofilin baz olarak davranıp, halojenin bağlı olduğu karbon atomuna komşu karbondan bir hidrojen atomu koparması ve aynı anda halojenin elektron çiftini alarak uzaklaşması ile yürür. Sonuçta iki karbon atomu arasında bir çift bağ oluşmuştur.

Dikkatlice bakıldığında koparılan hidrojenle ayrılan halojenin birbirine anti konumda olduğu gözükür, bu durum yeni π bagının oluşması için gerekli bir durundur.
E1 mekanizması, SN1 gibi iki basamak üzerinden yürümektedir, aslında her iki mekanizmanın da birinci basamakları , başlangıç maddesi alkil halojenürün yavaş bir ayrılma ile karbokatyon vermesidir.
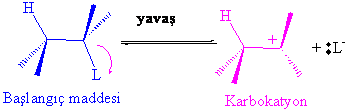
Bu basamakta da nükleofil yada bazın bir fonksiyonu yoktur. Daha sonra iki reaksiyon mümkündür. Bunlardan birincisi, nükleofilin oluşan karbokatyona atak yaparak SN1 mekanizması gereği ürün oluşturması, ikincisi ise baz olarak davranıp yine komşu hidrojenden bir hidrojen kopararak ilgili iki karbon atomu arasında çift bağ oluşturmasıdır.
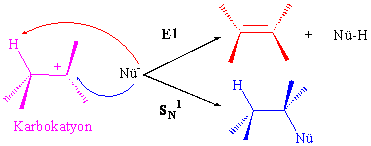
Yer değiştirme ve ayrılma tepkimelerinin karşılaştırılması
Her iki reaksiyonda bir nükleofil ve bir alkil halojenürle başladığına göre bu iki reaksiyonun paralel yürüyen iki tepkime olmalıdır. Bunlardan hangisinin daha baskın olacağını anlayabilmenin yolunu anlamaya çalışalım.
Tersiyer alkil halojenürlerde sadece SN1 mekanizması üzerinden yürüyebilirken, E1 ve E2 mekanizmalarından herhangi biri üzerinden yürüyebilir. Zayıf nükleofiller ve polar çözücüler içerisinde SN1 ve E1 mekanizmaları daha baskındır.

Bu reaksiyonda eğer HO- veya CN- nükleofilleri kullanılırsa ki bu reaksiyon için baz olarak davranır sadece eliminasyon ürünü elde edilebilir.
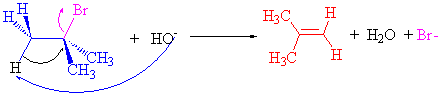
Primer alkilhalojenürler
Primer alkilhalojenürlerde kararlı karbokatyon oluşumu mümkün olmadığından sadece SN2 ve E2 mekanizmaları mümkündür. İşin gerçeği sadece SN2 mekanizması üzerinden yürür, sadece hacimce çok büyük nükleofiller baz olarak davranırlar ve eliminasyon reaksiyonu verdirebilirler. Bu durum aşağıda bir örnekle açıklanmaya çalışılmıştır.
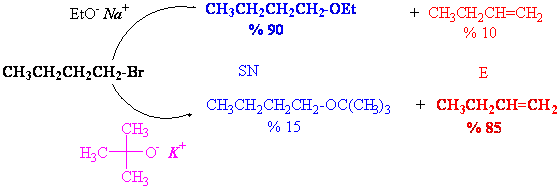
Potasyum tersiyer butoksit, görüldüğü gibi oldukça hacimli bir bazdır ve nükleofil olarak yaklaşmak yerine baz olarak proton koparmayı tercih eder.
Sekonder alkilhalojenürler
Sekonder alkil halojenürlerde, bu zamana kadar anlatılan tüm yer değiştirme ve ayrılma mekanizmaların tamamı mümkündür, sekonder alkilhalojenürlerin tepkimelerinde ortam şartlarına çok çok dikkat edilmelidir. Bu reaksiyonlarda nükleofilin gücü, büyüklüğü, baz olarak davranma yeteneği, çözücünün polarlığı, sıcaklık gibi etkenler hangi mekanizma üzerinden yürüyeceğinin bir işaretidir. Genel olarak iyi bir nükleofil olan fakat güçlü bir baz olmayanlarda SN2, zayıf nükleofil ve polar çözücülerde SN1, güçlü bazlarla ise eliminasyon E2 reaksiyonlarının olacağını söyleyebiliriz. Bu durumlara ışık tutacak bazı reaksiyon şartları aşağıda verilmiştir.

2-bromopropenin nükleofil ve bazın özelliklerine göre ürün dağılımlarını yukarıdaki açıklamalarla karşılaştırınız.
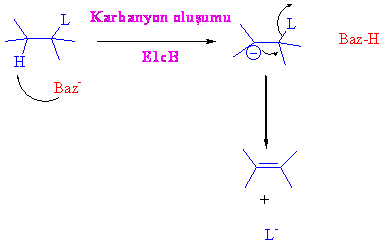
E1cB eliminasyonu
E1cB eliminasyonu diger iki eliminasyondan daha az karşılaşılan bir durumdur, farklılık E1 eliminasyonundaki ayrılan grubun öncelikle ayrılmasından ziyada daha asidik yapıda olan komşu protonun bir baz tarafından sökülerek karbanyon oluşumudur. Oluşan karbanyon genelde komşu grupların etkisi ile kararlı kılındığından direk E2 yerine E1cB tepkimesi vermektedir.