Stereokimya:(Kirallik)
Stereokimya, kimyanın bir moleküldeki atomlarının bağlanış şekillerini ve atomların
uzayda diziliş şekillerini inceleyen kısmıdır. Genelde atom sayısı ve bağ yapıları aynı olmakla
birlikte, uzaysal dizilişlerinin farklılığını anlatan izomerlik kelimesi ile birlikte anılır.
Organik
kimyanın kimya bilimi içerisinde çok geniş bir yer kaplaması ve hala
genişleyerek devam etmesinin kaynağı olan karbon atomunun, hibritleşme
ve uzaysal dizilişinde değişiklik arz etmesi özelliğidir.
Hibritleşme ve bunun sonucu uzaysal
dizilişi anlaşılmadan, organik kimyayı ve mekanizmaları anlamak
oldukça güç yada imkansızdır.
Stereokimyayı iyi anlayabilmenin yolu, organik kimyayı da iyi
anlayabilmenin ön şartı olan, atomların orbital
yapıları, özellikle de karbon atomunun hibrit
yapıları ve bu hibritleşmeden kaynaklanan uzaysal
dizilimleri ve kimyasal özelliklerinin anlaşılmasıdır diyebiliriz.
Periyodik
cetvelde çok sayıda element olmakla birlikte bu atomlar, proton sayılarına göre
(yada başka bir deyişle yüksüz atomun elektron
sayılarına göre), veya daha doğru bir açıklamayla, son yörüngesindeki
elektronlarına göre sıralanmıştır.
Nükleer
kimya dışındaki diğer kimyasal olayların diğer yörüngelerdeki elektronların
oldukça kararlı ve doymuş yapıda olmalarından kaynaklanan bir özellikle, son
yörüngesindeki elektron alışverişi veya ortaklaşması,
ile yürüdüğünü biliyoruz.
Organik
kimyada, organometalik yapılar hariç, tüm bağlar, kovalent veya polar kovalent
yapıdadır. Yani elektron ortaklaşması ile yapılan bir bağ şeklidir.
Kimyasal
bağların oluşumunu ve bu molekülün yapısı dediğimiz, uzaysal dizilişini de son
yörüngedeki elektronlar belirlemektedir.
Ayna görüntüsü, stereokimyanın en çok kullanılan terimidir. Bu zamana kadar
aynaya bakarken ne tür bir etki gösterdiğine dikkat ettiniz mi? Şimdi ayna
görüntüsü kavramına bir hazırlık yapalım ve hidrojen atomu yada
molekülünü kesen öyle bir düzlem bulalım ki bu düzleme koyulan bir ayna
molekülü ayna görüntüsü ile toplandığında tam göstersin."Bir elmanın iki yarısı" terimini hatırlayınız.
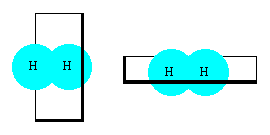
Dikkatlice
bakılacak olursa hidrojen atomunda yada hidrojen molekülünde molekülü tam
ortadan ikiye bölen , yada başka deyişle ayna görüntüsü kendini tamamlayan, sonsuz sayıda düzlem vardır.
Stereokimya'da molekülün üç boyutlu halinin kafada canlandırılması ve ayna düzleminin
varlığının yada yokluğunun bulunması oldukça önem
taşımaktadır. Hidrojen atomu veya molekülü için çok kolay gözüken bu durumun
tespiti daha kompleks moleküllerde biraz zorlaşabilir.
Periyodik
cetvelin ikinci elementi helyum, iki proton ve iki elektrona sahip olmasına
rağmen, soy gaz konumu gereği organik moleküllerde yer olmaz. Ama uzaysal
dizilişin anlaşılabilir olması için, ikili bağ yapan, son yörüngesinde iki
elektronu bulunan diğer elementlerin, Ca, Ba, Sr gibi elementlerin kovalent bağ yaptığı düşüncesi ile,
bağ yapıları ve uzaysal dizilişlerine de kısaca bir göz atmakta fayda vardır.
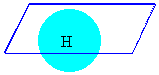
Eğer
merkez atoma bağlı her iki atomda aynı ise o takdirde bir tanesi horizontal (Dikey) , sonsuz sayıda da vertikal
(Yatay) ayna düzlemi bulmak mümkündür.(Hidrojen molekülü gibi)
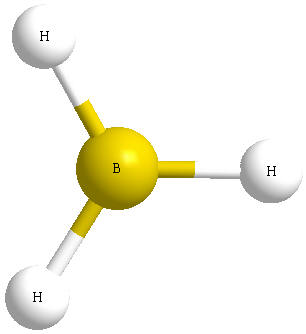
Üçüncü
atom olan bor atomu , 2S22P1
yapısına sahiptir. S-orbitalinin
küresel olduğu daha önce anlatılmıştı, P-orbitalleri ise her biri x,
y, z uzaysal geometriye dağılmış bir yapıda dır.
9; 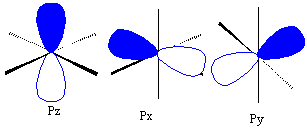
Konumuzun
bu kısmında çok dikkat edilmesi gereken bir kimyasal olaydan, hibritleşmeden,
daha önce bahsedilmişti.
Bor
atomunun , S2P1 yapısında
olduğunu söylemiştik. S ve P- orbitallerinin de
yapılarını ayrı ayrı anlatmıştık. Şu halde bor
atomunun yapacağı BH3 molekülünün yapısının nasıl olması gerektiğini
tahmin etmeye çalışalım.
Tahmini
bir yaklaşımla,
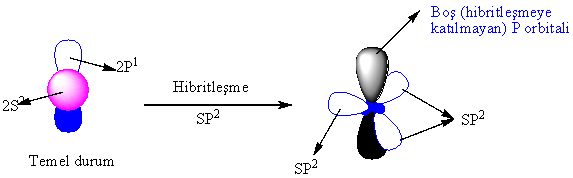
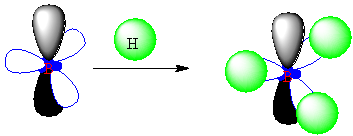
|
|
Klasik
bir düşünce ile, (hibritleşme yok yada
bir S elektronunun bir P orbitaline geçmesi)
molekülde beklediğimiz; iki tür bağ bulunması ve bunlardan da S-S bağının daha kısa olurken S-P bağının daha uzun olmasıdır. Moleküldeki
bağlanma bir T- şeklini oluşturacak şekilde düşünülebilir.
Bu
noktada çok dikkat edilmesi gereken durum bor atomunun spektroskopik
verileri ( aletlerle ölçülebilir özellikleri) göstermektedir ki, tüm bor
hidrojen bağları aynı yapıdadır ve bunlar ne s-s
nede s-p bağının aynıdır. Bağ yapıları
S ve P orbitalleri karışımına benzemekte ve bir S iki
P karışımı bir özellik göstermektedir. Yani bu yapı ve bağlar SP2 adı verilen bir yapıdadır.
Bu
durumu, hibritleşme
kavramı ile açıklıyoruz. Hibritleşme asıl olarak,
önceden bilinen atomik orbitallerin sonradan bulunan orbital yapısına uydurulması mantığıdır.
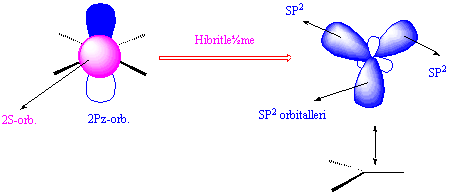
Atomik orbitali daha önce bahsedilen T yapısına benzeyen bor atomu moleküler halde iken SP2 denen yapıya geçmişti. Bu yapı şekil...da görüldüğü gibi düzlemseldir ( tek düzlemde) ve her bir orbital arasında 120° lik açılar vardır. Anlama kolaylığı açısından bir üçgene benzetilebilir. Orbitallerdeki adı geçen dönüşümün bir çok farklı açıklanış şekli bulunmakla birlikte genel anlamda bu olaya hibritleşme denir. En kısa ve öz anlamda hibritleşme, bir atomun son yörüngesindeki atomik orbitallerin karışarak enerji seviyeleri aynı olan yeni orbitaller sistemi oluşturması olarak tanımlanabilir.
![]()
Hibrit orbitalleri ile atomik elektron konfigurasyonu
arasında yazım benzerliği olmakla birlikte anlam kargaşasına yol açan bazı
farklılıklar vardır.
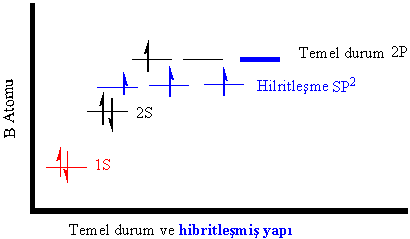
Bu farklılıklar kısaca;
1-Atomik
orbitaller yazıldığında, elektron konfigürasyonunda,
s, p, d, f gibi harflerin önünde bulunan 1, 2,
3 gibi rakamlar (K, L, M, N -yi ifade eden) baş
kuantum sayılarını gösterir. Hibrit orbitallerinde baş kuantum sayısı gösterilmez, son yörünge
elektronları olduğunun bilinmesi beklenir. Eğer hibrit
orbitalinin önünde bir katsayı varsa bu katsayı o hibrit (melez) orbitalden kaç
tane orbital olduğunu gösterir.
2-Atomik
orbital elektron konfigurasyonunda,s=0
olmak üzere s, p, d, f, yan kuantum sayılarını(l=0....
n-1) gösterir, ve tek harfle gösterilir, hibrit orbitalleri ise, SP2, SP3 gibi hibrite karışan ( hibriti
oluşturan) orbitalleri ve kaç tane olduğunu ifade
eden birkaç harfle gösterilir
3-En
çok karıştırıldığı için en önemli olanı da, atomik orbital
elektron konfigürasyonunda, orbitaller
üzerine yazılan rakamlar orbitallerdeki elektron
sayısını ifade etmekte, hibrit orbitalinde
ise, hibritleşme anında üzerine yazıldığı orbitalden kaç tanesinin hibritleşmeye
katıldığını gösterir.
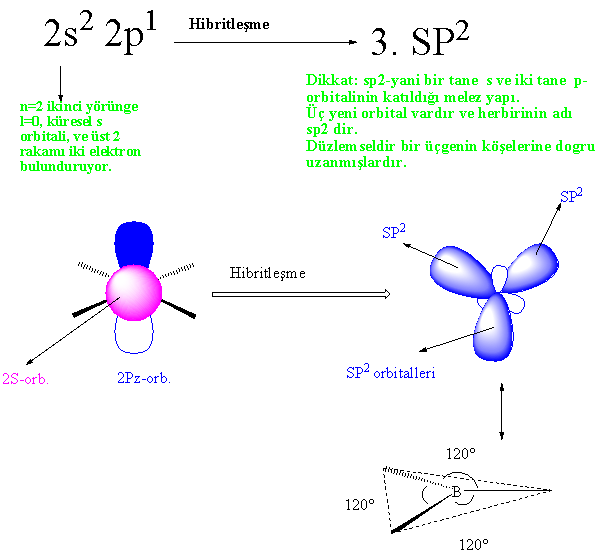
Şu
anda hem organik kimyanın hem de bir organik kimyacı için temel bilgi olan
karbon atomunun atomik yapısı ve moleküler yapısı hakkında daha fazla düşünmeye
hazırız.
Periyodik
tablonun altıncı elementi olan karbon atomu tabiatı gereği karbon kimyası denen
kendine has bir bilim dalı ortaya çıkarmış ve bu bilim dalının anlaşılması
biraz daha karmaşık olan üç boyutlu yapısı da stereo kimyayı doğurmuştur.
Kiral-akiral
kavramları (Kirallik-Charilaty)
Dünyadaki
tüm moleküller kiral ve kiral
olmayan olarak ikiye ayrılabilirler. Örnek olarak çorap ve eldivenlerimizi ele
alalım. Çoraplar birbirine o kadar benzerdir ki, aynı olduğunu söyleyebiliriz
ve hatta bunları farklı zamanda farklı ayaklarımıza giyebiliriz.
Eldivenlerimize gelince onlar her zaman ya sağ yada
sol elimize giyilen bir türdür.
Böyle
eldiven gibi zıttı ile bulunan maddelere kiral, her
biri aynı olan moleküllere ise akiral molekül denir.
Bir molekülün kiral mi yoksa akiral
mi olduğunu anlamak için bazı yöntemler vardır. Bunlardan en yaygın olanı
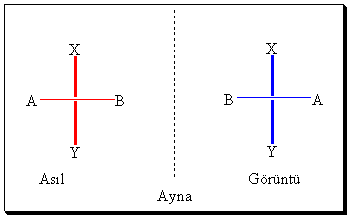
molekülün ayna görüntüsüne bakmaktır. Bilindiği gibi, ayna görüntüsünde bir cismin sağını solda, solunu ise sağda gösterir ve
üst ile alt konumlarını değiştirmez.
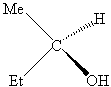
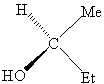
|
R-2-butanol |
S-2-bütanol |
Bir
kiral molekül ayna görüntüsü
kendisi ile üst üste çakışmayan molekül, bir akiral
molekül ise ayna görüntüsü ile üst üste çakışan molekül olarak
tanımlanmaktadır. SP3 hibriti yapmış olan
herhangi bir karbon atomuna eğer dört farklı gurup bağlı ise, bu molekül iki
farklı uzaysal diziliş gösterir. Bu iki molekül her biri eldiven örneği gibi
aslında birbirinden farklı moleküllerdir ve bunlara birbirinin enentiomeri denir. Çok
dikkatli bakıldığında her iki izomerin birbirinin ayna görüntüsü olduğunu
anlamak çok da zor değildir.
Konfigürasyon
ve R, S Adlandırmaları
Alkenlerdeki yapısal izomerlik, cis-trans veya E, Z gibi enantiomerlerin de bir birinden ayrı olarak
adlandırılmaları gerekir. İki enantiomerin birbirinin
ayna görüntüsü olması aynı zamanda bunların konfigürasyonlarının
da zıt yapıda olduğunu göstermektedir. Bunların adlandırılmasında R, S, kuralı yada Chan-Ingold-Prelog (CIP) denilen bir adlandırma sistemi vardır ki,
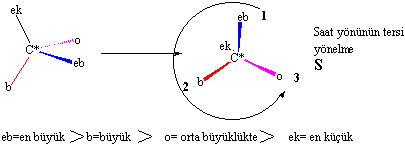
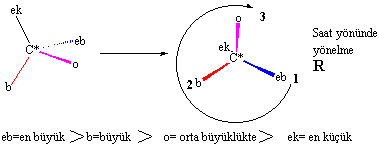
burada dikkat edilmesi gereken bazı kurallar vardır: Bu kural oldukça basittir,
en küçük grubun stereojenik karbon atomunun arkasına
getirilerek diğer üç grubun öncelik sırasına göre sağa (R) yada sola (S) doğru
yönlenmelerine bakılarak karar verilir.
Öncelik
sırasının bulunması daha önce cis-trans
adlandırmasında anlatılan öncelik sırası ile aynı olarak aşağıda tekrar
özetlenmiştir;
1-Grupların öncelik sırası
atom numaralarına göredir. Büyük atom numaralı elementler önceliklidir.
Cl (35.5)> O (16)> C (12) > H(1) gibi
2- Eğer kural 1 ile buna
karar verilemiyor ise yani; ilk bağlı atomlar aynı ise bu atomlara bağlı olan
ikinci veya üçüncü şeklinde devam eden atomlara bakılarak karar vermeye
çalışılır. (Çiftli yada üçlü bağlar aynı atomun iki
veya üç defa bağlanmış olduğu kabul edilerek hesaplanır.
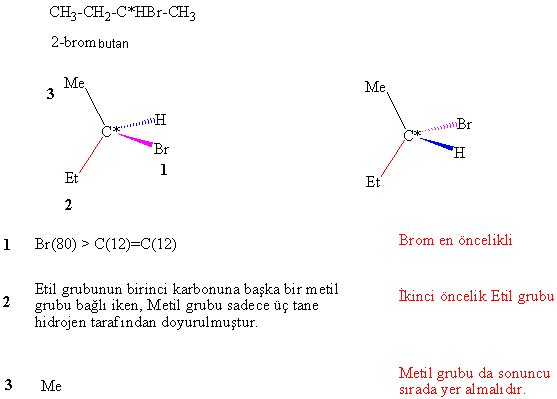
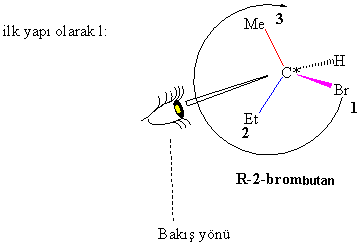
A/
2-bromobutan için her iki konfigürasyonu
da yazılıp adlandırınız.
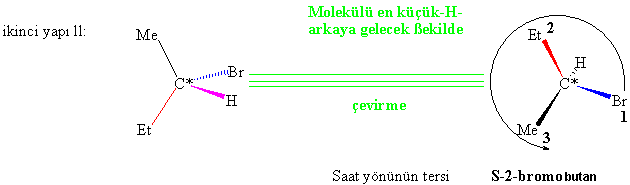
Bazen üç boyutlu molekülleri iyi gözlem ve anlama için iki
boyutta düşünmemize kolaylık sağlayan Fischer
projeksiyonuna bir daha bakmamız gerekecektir.
FİSCHER PROJEKSİYONU
Projeksiyonla
moleküllerin gösterimi ilk defa alman kimyacı Emil Fischer tarafından şeker moleküllerinin mutlak yapılarının
gösterimi için önerilmiştir. Bu yöntem hala bazen karbonhidratların ve tetrahedral karbon atomlarının gösteriminde kullanılan bir
yöntemdir. Fischer projeksiyonu
da çok basit olmasına rağmen özel bir itina istemektedir.
Projeksiyon temel kuralları şöylece sıralanabilir.
1-Molekül, uzun zinciri
yukarıdan aşağıya doğru (dikey-vertical) gelecek
şekilde çizilir.
2-Öncelik sırası bulunan grup
molekülün en üst kısmına gelecek şekilde düşünülür..
3- Dikey-vertical-bağlar
düzlemin arka tarafında, yatay-horizontal- bağlar ise
düzlemin ön tarafında kabul edilerek çizilir
Örnek
olarak (R)-2-kloropropanalın Fischer
projeksiyonu ve ok-çizgi formunu inceleyelim.
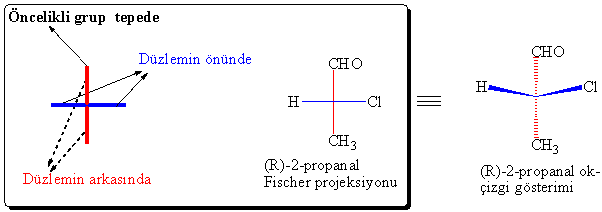
Fischer
projeksiyonunda en önemli olan ve sürekli hatırda
tutulması gereken kural üçüncüsüdür, bazen diğer iki kurala dikkat edilmeksizin
çizimler de yapılabilir. Bundan dolayı da bazen yanlış anlaşılmalar, yada yanlış gösterimler olabilir. Eğer 2-kloropropanalin
90° döndürüldüğü duruma dikkatlice bakacak olursak burada hata yapılma ihtimali
olan noktaları görürüz.
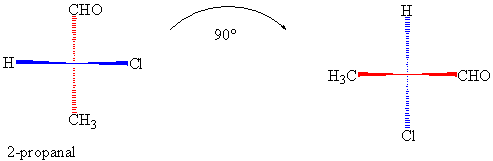
Burada
gösterilen moleküller aynı moleküller değil birbirlerinin enantiomeridir.
(?)
S / (R)-2-kloropropanalın
izdüşümünün 180 ° döndürülmesi aynı molekülümü yoksa başka bir yapımı verir ?
Fischer
projeksiyonunda birden fazla karbon atomu için
çizildiğinde çakışık konformasyon yapısının
gösterildiği de dikkatinizden kaçmayacaktır.
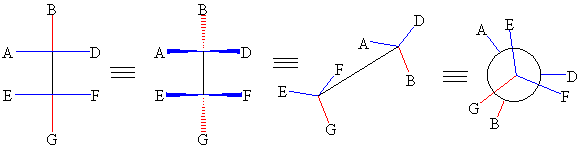
A / Aşagıdaki
moleküllerin Fischer projeksiyon
modellerini çiziniz.
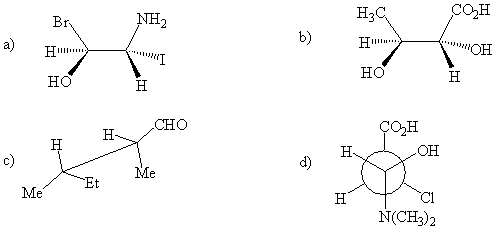
ORGANİK MOLEKÜLLERDE
STEREO İZOMERLİK.
Polarize ışık Ve Optikçe Aktiflik
Normal
bir ışık düzlemde her yöne doğru yayılır, yalnız bu ışık belli bazı maddelerden
geçirilirse ışık tek düzleme toplanabilir. Bu tür bir ışığa düzlem polarize ışık yada
kısaca polarize ışık denir. Bu tür bir ışık kalsiyum karbonattan oluşan ( Nicon prizma) ile elde edilebilmektedir. Yenilerde
sentezlenen polaroid adlı malzeme de yaygın olarak kullanılmaktadır.
Maddelerin
ışıkla etkileşmelerini gösteren bir alet olan polarimetre polarize
edilmiş bir ışığın bu madde içerisinden geçirilmesi ile değişimleri ölçen bir
cihazdır. Basit bir şema ile polarimetre yi tanımaya
çalışırsak;
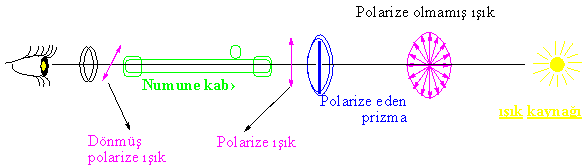
Bir polarimetrede numune kabına koyularak polaritesi ölçülen maddeler
için üç ihtimal vardır.
1-Polarize ışığın yönünü hiç döndürmemesi, ki bu maddenin optikçe aktif olmadığını (Eğer meso değil ise) gösterir.
2-Polarize ışığı sağa
çevirmesi dextrarotatory (+) sağa çeviren.
3- Işığı sola çevirmesi Levorotatory (-) sola çeviren.
Herhangi
bir ölçüm anında ışığı sağa yada sola çevirdiğinin
bilinmesi de mümkün değildir. Eğer ışık + 10° sağa gözüküyor ise bu gerçekten +
10° sağ mı, yoksa - 350° sol mu diye bir karışıklık ortaya çıkar ki bu durum,
ancak konsantrasyona bağlı bir durum olduğu için ,
konsantrasyonu değiştirilerek anlaşılabilir.
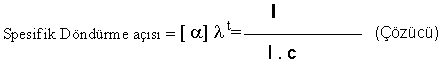
Formülde,
l desimetre olarak numune kabının
uzunluğu
9; a spesifik döndürme açısı
c; g/ml olarak konsantrasyon
t;
çözeltinin °C olarak sıcaklığı
9; 9; l ışığın dalga boyu ( Sodyum lambası için bu değer 589.3 nm)
Enantiomerler, farklı kirallik göstermelerine rağmen,
erime-, kaynama noktaları, yoğunlukları, ve bir çok spektroskopik verileri itibarı ile aynı özellikleri
gösterirler ve fiziksel metotlarla kolayca birbirlerinden ayırt edilemezler. Enantiomerlerin biri polarize ışığı sağa çevirirken diğeri sola ( birbirine
zıt) çevirmekle beraber, çevirme açıları aynıdır.
50:
50 % oranındaki bir enantiomerler karışımı optikçe
aktiflik göstermez. Çünkü toplam çevirme açısı sıfır olur. (Rasemik
karışım)
Konfigürasyonu belirleyen R, S gösterimleri ve polarize ışığı
döndürme arasında herhangi bir ilişki yoktur. Yani R yada S olan herhangi bir enantiomer polarize ışığı sağa yada sola çeviriyor olabilir,
bu durum ancak deneysel olarak bulunabilir.
Örnek
olarak R-laktik asit ışığı sola çevirmekte (-), fakat bunun metil esteri hala R
olmakla birlikte ışığı sola çevirmektedir.
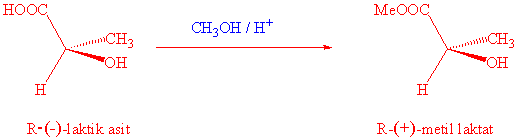
Enantiomerler kimyasal özellikleri benzemekle birlikte biyolojik özellikleri
bakamından farklı özellikler gösterirler.Örnek olarak,
enzimler (+) laktik asiti pürivik
asite dönüştürürken, (-) laktik asiti
dönüştürmezler.
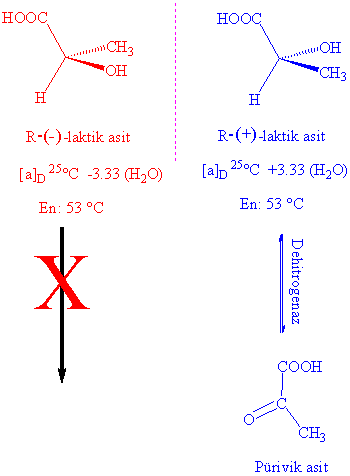
Karbon
atomunun SP3 hibrit yapısından kaynaklanan
özelliklerden biride, aynı molekülün birden fazla üç boyutlu formunun bulunduğu
olduğundan daha önce bahsetmiştik. Diastereomer ve enantiomer kavramları enantiomerlerin
öncelikle anlatılmasından dolayı bazen karışmaktadır. Oysa genel anlamda birden
fazla uzaysal dizilime sahip olan bu moleküllerin her birine diğerinin stereoizomerleri yada diastereoisomeri denir.
Diastereomerleri bu şekilde kavradıktan sonra, diastereomerlerin birbiri ile ayna görüntüsü ilişkisi
olanlarına da özel olarak enentiomer
dendiğini öğrenirsek bilgiler daha kalıcı olur.
Aşağıdaki
2S,3R-2-kloro-3-fenilbutan molekülünü dikkatlice inceleyip anladıktan sonra
bir model olarak hatırda tutmaya çalışınız.
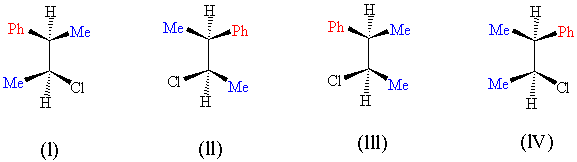
Yukarıdaki
dört molekülde uzaysal dizilişleri itibarı ile farklı olmalarına rağmen atom ve
bağ sayısı açısından ve kapalı formülü açısından aynıdır. Bunlar birbirlerinin diastereomerleridir, fakat bu maddeler içerisinde
birbirlerinin ayna görüntüsü olanları vardır. (özel olarak enantiomer
diye adlandırılanlar).
Şimdi
bu moleküllerden hangilerine diastereomer,
hangilerine enantiomer diyeceğimizi ayırt etmeye çalışalım. Eğer (l) nolu molekülü ele alır ve diğerleri ile karşılaştırırsak
bunlardan (ll) numaralı molekülün (l) numaralı
molekülle ayna görüntüsü ilişkisi bulunduğunu ve diğerleri ise bunlardan her
hangi biri ile ayna görüntüsü ilişkisi içerisinde bulunmadığını görürüz.
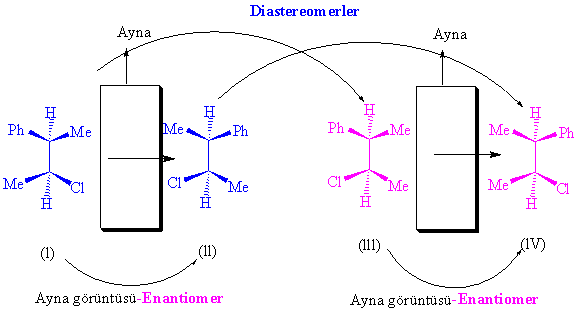
Buradan
da anlaşılır ki (l) ve (ll) birbirlerinin enantiomeridir, (lll) ve (lV) ise (l)in diastereoisomerleridir.
Diastereoisomerlere kısaca diastereomer de
denir.
Fiziksel ve kimyasal açıdan enantionerler
birbirlerine benzerken, diastereomerler büyük
farklılıklar gösterebilirler.
Bunlar farklı erime noktalarına, kaynama noktalarına ve fiziksel sabitlere
sahip olurlar. Reaksiyon esnasında hızları farklı olabilir ve farklı ürünler
verebilirler. Bu farklardan yararlanılarak bazen enantiomerlerin
birbirinden ayrılması sağlanır.
2-fenilamino-1-propanol tabiatta farklı diastereomerleri
şeklinde bulunan bir maddedir. Tabiatta 1S,2R ve 1S,2S diastereomerlerinin her ikisi de bulunur. Bu iki bileşik
farklı erime noktalarına ve fiziksel özelliklere sahiptirler ve her ikisi de
tıbbi malzeme olarak kullanılırlar, biyolojik aktivite açısından benzerliklerde
vardır. 1S,2R izomeri (ilk defa genus efedra isimli bir Asya bitkisinden) izole edilmiş) (-)-efedrin olarak adlandırılır
ve bronşit (astım) ilacı olarak kullanılmış sonraları, kalp rahatsızlığı tümör
oluşturma, ağızda kuruma gibi yan etkileri olduğundan kullanımdan çekilmiştir.
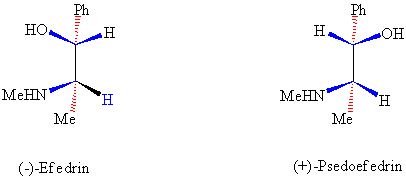
1S,2S
izomeri (+)-psodoefedrin ise kan basıncını düşürücü
ilaç olarak kullanılmaktadır.
S / Aşağıdaki her
bir molekül çiftinin enantiomer yada
diastereomerlik durumlarını irdeleyiniz. (s-bağları etrafında
serbest dönme olabildiğini hatırda tutunuz)
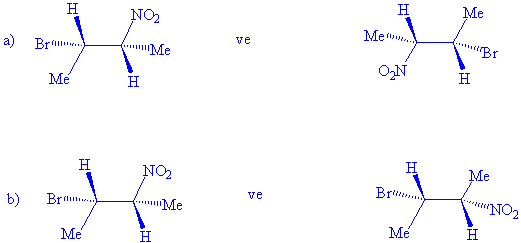
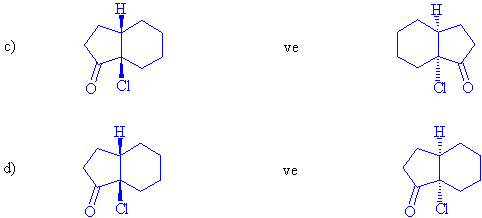
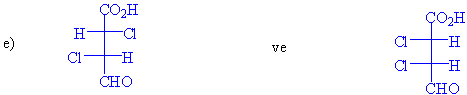
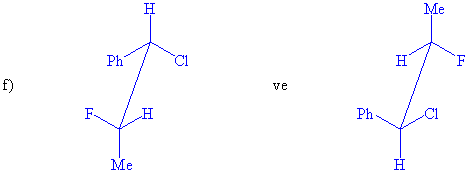
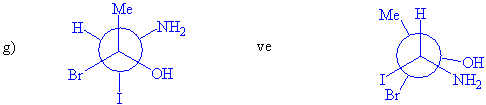
2-kloro-3-fenilbutan molekülünde iki tane asimetrik karbon atomu ve
dört tane stereoizomer vardır. Bu dört yapıdan
birisini mutlak yapı olarak tayin ve tespit etmek mümkündür. Bunun için 2 ve 3
numaralı karbon atomlarının mutlak konfigürasyonlarını bilmemiz gerekmektedir
ki bunlar (l) 2S,3R; (ll) 2R,3S; (lll)2R,3R;
(lV) 2S,3S dır.
Her
iki asimetrik karbon atomu (stereojenik merkez)
içeren molekülün dört tane stereoizomeri olduğu da
doğrudur.
A / 2-bromo-1-kloro-1-fenilpropanın stereoizomerlerini,
enantiomerlerini ve diasteremerlerini
gösteriniz.
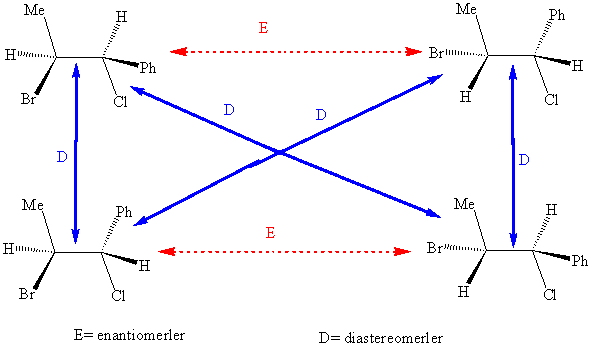
ikiden fazla stereojenik
merkez bulunduran yapılar.
İkiden
fazla asimetrik karbon içeren moleküller tabii ki dört den de fazla stereoizomer içerirler. Aslında stereoizomerlerin
hesabı için basit bir formülde vardır.
Üç
tane stereojenik merkezi bulunan bir molekülü ele
alalım. Her bir stereojenik merkez S veya R olarak
sıralanabildiğine göre, bu üç merkez sırası ile, R,R,R ; R,R,S;
R,S,R ; S,R,R ; S,S,R ; S,R,S ; R,S,S ; ve S,S,S olarak sıralanır ve 8 tanedir.
Dikkat edilirse bu 23 şeklinde yazılabilir. Daha önce incelediğimiz,
iki asimetrik karbon atomu içeren molekülde de 4 stereoizomer
vardı yani 22 şeklinde yazılabiliyordu. Buradan
da genel olarak n tane asimetrik karbonu bulunan bir yapı için 2n tane
stereoizomer yazabiliriz demektir. Bilinen
bazı örnekler üzerinde stereoizomerler sayılarını
bulmaya çalışalım. Örnek olarak tane asimetrik karbon atomu bulunduran,
Penisilin G, altı asimetrik karbonlu vitamin D2 ve yedi asimetrik karbonlu androsteronu ele alalım.
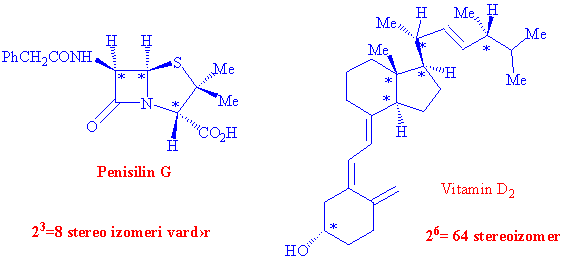
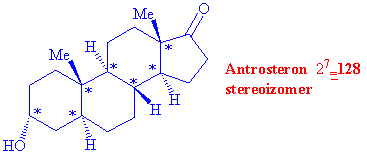
Antrosteron 128 çeşit uzaysal dizilişe sahip olabilen bir moleküldür ve total
sentezi için tüm olasılıklar düşünüldüğünde, stereokimyasal
reaksiyonların tabiatta oldukça kolay olmasına rağmen, laboratuarda ne kadar
zor olduğunu anlamak çok da zor olmasa gerek. Yukarıdaki örneklerden de
anlaşıldığı üzere organik kimyada bazı molekülleri iyi anlamaya karbon atomu ve
hibrit yapılarını, ve
fonksiyonel grupları tanımak da kafi gelmemektedir. Molekülün üç boyutlu
yapısının tam olarak anlaşılması ve anlatılması gerekmektedir.
Şimdi
iki asimetrik karbonu bulunan basit bir molekülde uzaysal dizilimi anlamaya
çalışalım.

Şimdi
bu iki molekülün, stereokiyasal açıdan nasıl gözüktüklerine
bir bakalım.
molekül
anın trans-, molekül b'nin
ise cis- bağlı olduğu açıkça
gözükmektedir. Molekül -a- her iki bağıda ekvatoriyal
-b-nin ise bağlantıları bir aksiyal
bir ekvatoriyaldir.
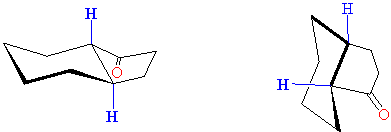
Trans ve cis bağlantılı bu
moleküllerdeki büyük değişimi daha rahat anlamanın belki de en iyi yolu en
azından basit iki boyutlu molekülleri üç boyutlu olarak tasavvur edebilecek
duruma gelinceye kadar, kimyasal modellerle üç boyutlu modellemeler yaparak
çalışmaktır.
Meso yapılar
Bir
yapının hem asimetrik karbon atomuna sahip olması hem de chiral
(kiral) olmaması mümkündür. Bu durum aynı substituentlere farklı simetri düzlemlerine sahip olan
moleküllerde geçerlidir. Molekülde birden çok asimetrik karbon atomu
bulunmasına rağmen optikçe aktif değildir. Genelde aynı substitüentlerin
gösterdiği bir simetri düzlemi vardır ve bu tür moleküllere meso
formu denir.
Meso
yapılı bir molekül olarak, cis-siklobutan-1,2-diol örnek verilebilir. Cis-siklobutan-1,2-diol iki asimetrik karbon atomu içerir. Asimetrik karbon
atomlarına bağlı substituentler de birbirlerinin
aynıdır.
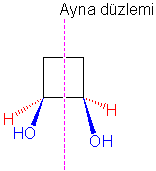
Molekülde
ayna düzlemi bulunduğuna göre chiral değildir.
Trans-1,2-dihidroksisiklopropan da iki asimetrik karbon atomu ve aynı
substituentler olmasına rağmen molekülde ayna düzlemi
yoktur yani molekül chiraldır. İki enentiomerik yapısı vardır.

S / 1,2-dihidroksisiklobutan
molekülünün stereoizomerlerini, enentiomer,
diastereomerlerini irdeleyiniz.
cis-siklobutan molekülü basit yapılı bir molekül olmasından dolayı meso formunun hatırda tutulması için iyi bir model
olabilir. Meso tartarik asitte çok ca örnek olarak ele alınır. Tartarik asitte meso yapısı bulunmasından dolayı sadece üç stereoizomere sahidir. Molekülün ayna düzlemini ve
izomerlerini rahat gözlemlemek için Fischer projeksiyonu kullanışlıdır.
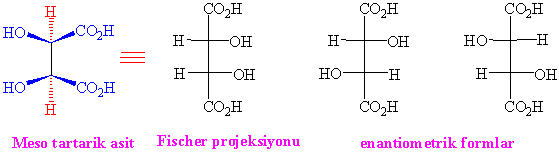
S / Aşağıdaki moleküller için
meso formlarını ve ayna düzlemlerini
gösteriniz.
Stereokimyada bilinmesi gereken kavramlar,
1-Konformerler, 2-Konfigurasyon 3-izomerleri,
4- Kiral, 5- Akiral, 6-Enantiomer, 7-diastereomer.