5-AROMATİK BİLEŞİKLER.
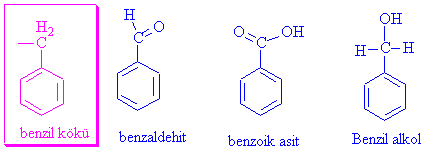
Organik kimyada çok geç tanınan, yapısı ve reaktifliği çok geç anlaşılan bileşiklerdir. İlk önce kimyacıların karşısına çıkan C6H5- temel yapısını içeren moleküller anlaşılmakta güçlük çekilen kimyasal özellikler göstermiştir. Örnek olarak, acı bademden izole edilen, benzaldehit, Kuzey batı Asya bitkilerinin sakız ve reçinelerinden elde edilen benzil alkol ve Güney Amerika bitkilerinden Tolu-balsamdan elde edilen toluen gibi maddelerin hepsi yapılarında basit C6H5- yapısını içermekteydi ve hepsinin de oksidasyonu ( Yükseltgenmesi) benzoik asit vermektedir.
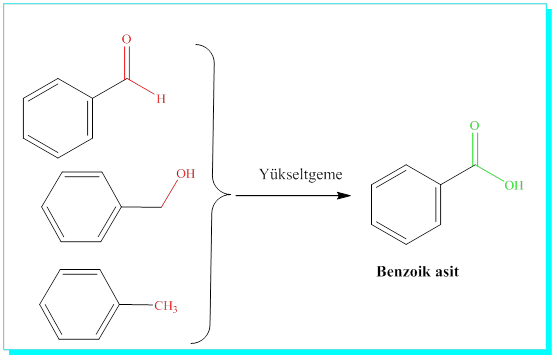
Benzoik asit ise kireçtaşı ile ısıtıldığında C6H6 formülünde aşırı derecede doymamışlık içeren bir molekül vermektedir. Bu aşırı doymamışlık doymuş hidrokarbon C6H14-hekzan ile karşılaştırıldığında daha rahat anlaşılabilir. Yapı çok sayıda çiftli yada üçlü bağ içermelidir.
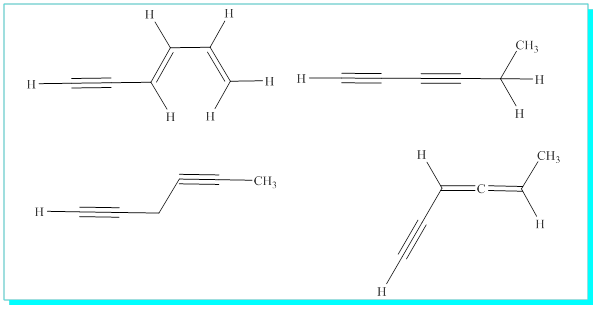
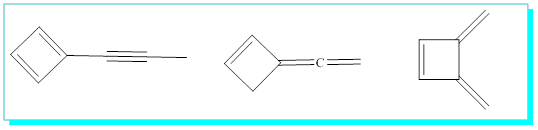
S / Kapalı formülü C6H6 olan tüm molekül yapılarını yazınız.
Bunları açık ve halkalı yapılar olarak ikiye ayırmak faydalı olacaktır.
Açık yapılardan bazıları,
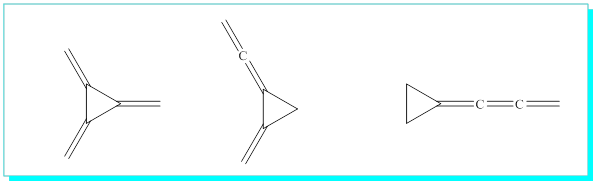
Halkalı yapılardan bazıları,
a) üçlü halkalılardan bazıları;
b) Dörtlü halkalılardan bazıları;
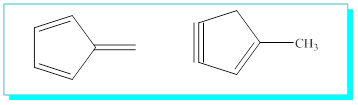
 Beşli
halkalı yapılardan bazıları;
Beşli
halkalı yapılardan bazıları;
Altılı halkalı yapılardan bazıları;
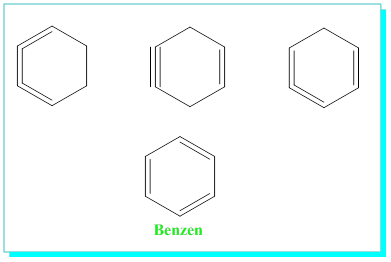
Molekül formülündeki aşırı doymamışlığa rağmen benzen birçok reaksiyonları vermemesi ile dikkatleri çekmiştir.
1: Örnek olarak, alkenler ve alkinlerin kolayca verdiği katılma tepkimelerimden, brom katılmasını, permanganat yükseltgemesini vermemekte, yer değiştirme reaksiyonları vererek bir doymamış bileşik gibi davranmaktadır. Buda kimyacıları şaşırtan başka bir özellik olmuştur.
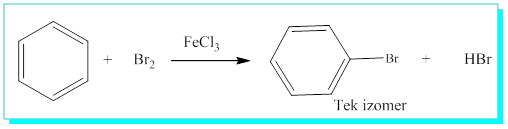
Örnek olarak, benzen bromla direk katılma ürünü vermezken;
![]()
Demir (III) bromür yardımı ile substitusyon (Yer değiştirme) reaksiyonları vererek HBr ortaya çıkarmaktadır.
![]()
Klor gazı da brom gazına benzer reaksiyon vermektedir.
2-Mono bromo- ve mono klorobenzen gibi C6H6da ki hidrojen atomlarından biri yerine bir halojen geçmesi sonucu oluşan ürünlerde bir izomerlik gözlenmemiştir. Buda bize benzendeki her bir altı hidrojenin eşit olduğunu göstermektedir. Ancak bu durumda hangi hidrojen yer değiştirirse değiştirsin aynı molekül oluşabilir.
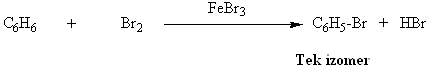
3-Eğer oluşan mono-bromobenzen yeniden bir yer değiştirme reaksiyonuna tabi tutulursa üç tane dibromo ürünü (üç izomer) oluşmaktadır.
Mono substitue benzende beş hidrojen var iken üç tür ürün oluşumu da burada üç tür hidrojen olması gerekliliğini ortaya çıkarır. Oluşan ürün oranları da eşit değildir bunlardan ikisi daha fazla oluşurken biri oldukça azdır.
Benzenin yapısının anlaşılabilmesi için bu şartları sağlayan bir molekül yapısı bulunmalıdır.
Kekule benzen formülü: 1865de Kekule benzen için bu şartları sağladığını düşündüğü, kabul edilebilir bir molekül yapısı önermiştir. Bu yapı bir altıgenin altı köşesinde altı karbon atomu ve bunlara bağlı altı hidrojeni içermektedir.
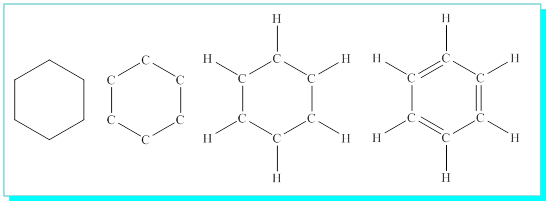
1: Bu durumda dahi benzenin alkenler gibi kolayca katılma reaksiyonu vermeyip doymuş hidrokarbonlar gibi davranmasını açıklamak daha da zor olmuştur. Kekule benzendeki bir çift-bir tek bağın ( konjugasyon) sürekli birbirine dönüştüğünü ve bu durumda da molekülün alkenler gibi davranmadığını savunmuştu.
Şimdi de diger şartların nasıl sağlandığına bir göz atacak olursak,
2- Mono substitue ( tek grup bağlı) benzenin tek izomer olarak ürün vermesi, örnek olarak demir (III) bromür katalizörlüğünde brom katılması sonucu tek izomer oluşmuştu.
Bu durumun açıklanması şimdi daha kolaydır, molekül yapısı gereği hangi hidrojen yer değiştirirse değiştirsin, oluşan ürün aynıdır.
3-Eğer monobromo benzen tekrar bromlanırsa üç çeşit ürün oluşur ki bunlar birbirinin izomeridir. Burada dikkat çekecek kadar önemli husus ise, bir hidrojenin yer değişmesi sonucu artakalan C6H5 yapısında beş hidrojenin eşit olmadığı ve bunlardan ikişer tanesinin eşit bir diğerinin farklı olmasıdır. Yani beş tane hidrojen üç çeşit ürün veriyorsa burada sadece üç çeşit hidrojen olmalıdır. Mono bromo benzenin Kekule formülünü yazarsak;
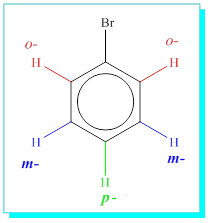
Yapıda gerçektende üç değişik hidrojen atomunun olduğunu görebiliriz.
a) Bunlardan iki tanesi hemen birinci bağlanan broma yakın olanları ki bunlara bağlanan başka bir atom aynı ürünü o-( orto) verir.
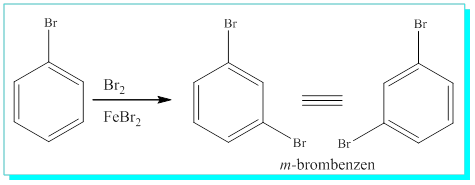
b) Diger ikisi ilk bağlanan broma iki karbon uzaklıktaki bağlanma konumudur ki buda aynı ürünü m-( meta ) verir.
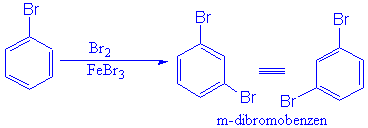
c) İlk bağlanan broma tam karşılık gelen karbon atomudur ve tekdir. Tek ürün verebilir. P-(Para)
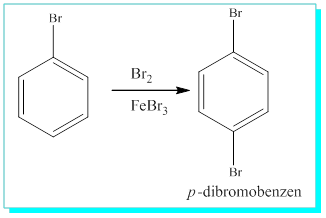
Böylece mono substitue benzenin ikinci substitusyonda neden üç tür ürün verdiği de anlaşılabilir.
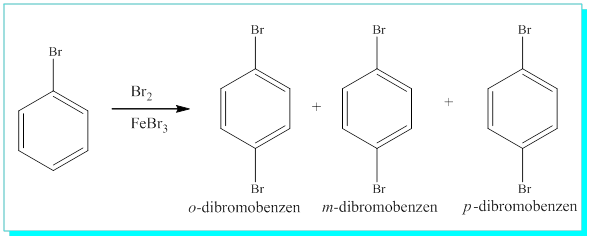
S / Kekule formülü ile o-dibromobenzende iki brom arasında tekli ve çiftli bağlar olma ihtimaline karşın, bunların tek bir molekül olarak davranması nasıl açıklanabilir?
Benzendeki tüm karbonlar sp2 hipritleşmesi yapmıştır. Buna göre benzeni s-bağları yapmış hali ile yazarsak.

Kekule yazımında bir çift-bir tek bağ ( konjuge) yapı gibi gözükse de aslında,
|
|
Burada dikkatlice bakıldığında her bir P orbitalinin, π bağı yapabileceği iki farklı P-orbitali olduğunun gözükmesi çok da zor değildir. |
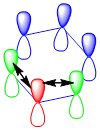
Bu durum oluşacak olan π bağlarına ayrı bir özellik katar ki buda aromatiklik diye adlandırılır. Yani her bir P orbitali aynı zamanda iki farklı atomun P-orbitalleri ile π oluşturuyormuş gibi davranır.
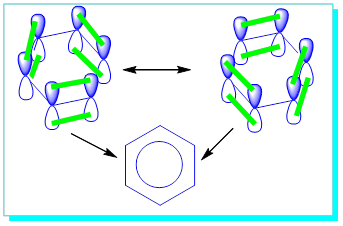
Bu durumu gerçeğe daha uygun olması açısından altılı halka içine çizilen bir daire ile gösteririz ve buda bize her zaman bu çift bağların rezonansa benzer şekilde bir değişim gösterdiğini, molekül üzerinde ve altında dönen elektron bulutları halinde olduğunu (aromatik) gösterir.
Aromatik yapısından dolayı benzende tüm bağ uzunlukları aynıdır ( 1.39 A°), bu uzunluk ise tekli bağdan (1.54 A°) daha kısa, çiftli bağdan ( 1.34 A°) daha uzundur.
Aromatik bileşiklerin isimlendirilmesinde IUPAC kuralları geçerli olmakla birlikte, bazılarının özel adları vardır ve bunları ezbere bilmek gerekmektedir.
Örnek olarak bazı özel isimli aromatik bileşikler
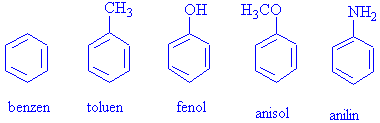
IUPAC kuralına göre mono substitue ( tek grup bağlı) benzenlerin adlandırılmaları
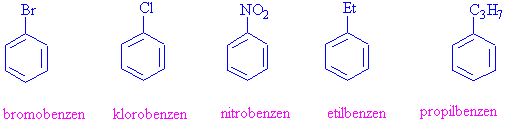
Disubstitue ( iki grup bağlı) olan benzen türevleri için ise ikinci substituentin konumunu belirtmek gerekmektedir. Bunlarda özel adlandırmaya tabiidir ve birbirine yakın olan konumlar o- ( orto-) , aralarında bir CH-olan konum m (meta-) ve karşılıklı konum ise p-(para-) olarak adlandırılır.
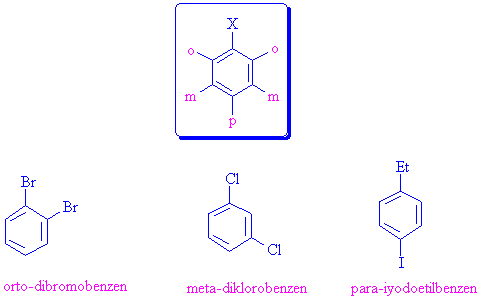
Eğer ikiden fazla substituent varsa, ilk substituent C-1 olarak numaralandırılır ve IUPAC kurallarına dikkat edilerek adlandırma yapılır.
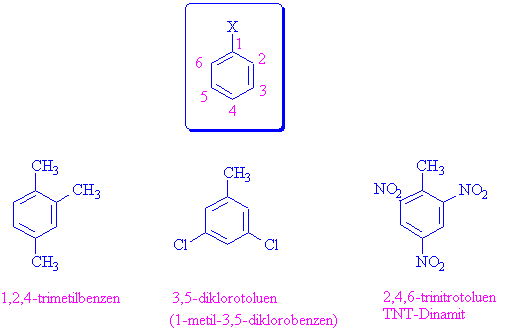
İsimlendirmelerde özel adı olan molekül ana kök olarak kullanıldığı gibi, bir substituent olarak da kullanılabilir.
S/ Aşağıda isimleri verilen moleküllerin açık yapılarını yazınız.
a) p-nitrofenol b) m-dinitrobenzen c) o-bromotoluen
d) 1,3,5-trimetil benzen e)4-bromo-2,6-diklorotoluen
Aromatik kendilerinin çok önem arz etmediği durumlarda, yapılardan bazılarının kısaltılmış gösterimleri vardır, ( Alkiller için R- kullanıldığı gibi..) bunlar sırası ile Ar- aromatik yapı ( genelde benzen), C6H5- yada Ph- fenil, C6H5-CH2-, benzil,
Örnek olarak, Benzil alkol C6H5-CH2OH veya Ph-CH2OH, İyodobenzen Ph-I olarak yazılabilir. Benzilbromürü de siz yazmaya çalışınız?
Benzende Rezonans Enerji Kararlılığı
Daha önceleri konjuge yapıların açıklanmasında, rezonans yapı gösteren moleküllerin, rezonans yapısı olmayanlara göre daha kararlı olduğunu görmüştük. Bu durum benzende çok daha belirgindir, yani benzenin rezonans enerji kararlılığı oldukça fazladır ve kararlılığın ne kadar olduğu, deneysel olarak da hesaplanabilmektedir.
Alkenlere hidrojen katılması, ekzotermik (ısıveren) bir reaksiyondur ve her bir çift bağ için yaklaşık 26-30 Kcal/mol enerji açığa çıkarır. Bu enerji farkı alkene bağlı guruplardan kaynaklanmaktadır.
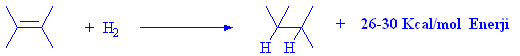
Eğer iki tane çift bağa hidrojen katılırsa iki katıda enerji açığa çıkmaktadır.
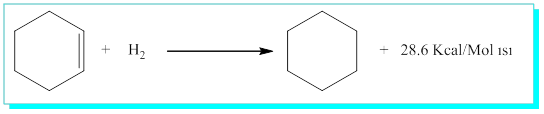
Benzenin rezonans kararlılık enerjisinin hesabı için, Siklohekzen, siklohekzadien ve siklohekzatrien (Benzen) yapıları ayrı ayrı incelendiğinde,
Siklohekzen için,
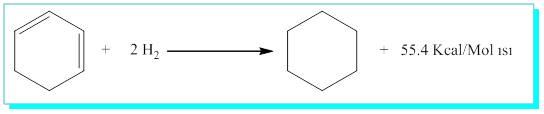
1,3-Siklohekzadien için;
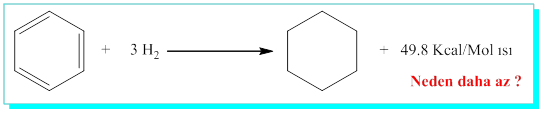
 Siklohekzatrien (Benzen) için
;
Siklohekzatrien (Benzen) için
;
 Benzenin
açığa çıkardığı enerjinin düşüklüğü dikkatinizi çekmiş olmalı!
Benzenin
açığa çıkardığı enerjinin düşüklüğü dikkatinizi çekmiş olmalı!
Benzenin gerçek yapısı Kekulenin önerdiği 1,3,5-siklohekzatrienden daha farklı özellikler içermelidir. İste burada benzenin aromatik yapıda olduğu ve rezonans enerji karalılığının ise, 3 x 28.6 - 49.8 = 36 Kcal/mol olduğunu söyleyebiliriz. Aromatik yapılar bu rezonans enerjilerini korumak için * Dünyadaki tüm nesnelerin en düşük enerjili yapıyı tercih ettiği termodinamik yasasını hatırlayınız* katılma tepkimesi vermeyip yer değiştirme reaksiyonu verir.
Elektrofilik Aromatik Yer değiştirme Reaksiyonları.
Aromatik yapılardaki bir çok reaksiyon, yapıdaki bir hidrojen atomu ile bir başka atom yada grubun yer değiştirmesi ile oluşur. Bu yer değiştirme reaksiyonlarından bazıları aşağıda özetlenmiştir.
1-Bromlama;

2-Nitrolama;
3-Sulfolama;

4-Alkilleme; (Fridel--Craft)

5-Fridel--Craft açillemesi ; R-CO- (açil),
Aktive ve Deaktive Edici Gruplar
Benzene bağlanan herhangi bir substituent benzenin reaktivitesini değiştirir, yani yeni molekül reaksiyon vermede benzenden daha aktif yada daha az aktiftir. Bağlanan grup benzeni ikinci bir yer değiştirme reaksiyonu için aktive yada deative etmiştir.
Örnek olarak, bazı mono substitue benzenlerin nitrolama reaksiyonuna bir bakalım,
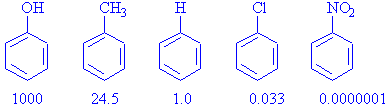
Benzenin nitrolanma hızı 1.0 alındığında, -OH grubu ve -CH3 grubunun reaksiyonu hızlandırdığı ( aktive ettiği) -Cl ve -NO2 grubunun ise yavaşlattığı deaktive ettiği gözlenir. Bağlı bulunan grupların elektron verici olmaları benzen üzerinde zaten var olan elektron yoğunluğunu daha da fazla artırarak, daha hızlı reaksiyon vermesini sağlarken, elektron çekici gruplar benzendeki elektron yoğunluğunu azaltarak, reaksiyon verme yeteneğini düşürürler (deaktive ederler).
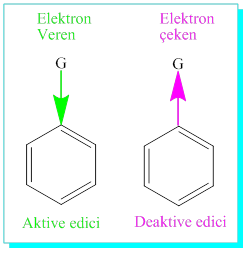
Orto-para ve Meta- yönlendiriciler
Benzendeki ilk substituent ikinci gelenin reaktifliğini etkilediği gibi molekülün hangi pozisyonuna bağlanacağını da beliler. İlk substituentten sonra mümkün üç tür hidrojen olduğunu (o-, m-, p- )daha önce görmüştük. Bunlardan o- ve p- konumları aynı zamanda aktive yada de aktive edildiği için ikinci bağlanacak olan atom yada grubun iki ihtimali vardır, bunlar o-, p- ve m-dır.
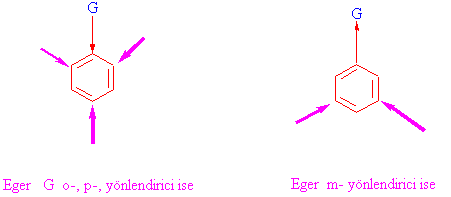
Örnek olarak, Toluenin nitrolanması, o- ve para ürün verirken,
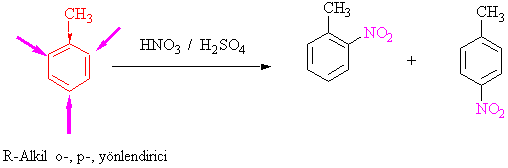
nitrobenzenin ikinci defa nitrolanması yalnızca m-ürün vermektedir.
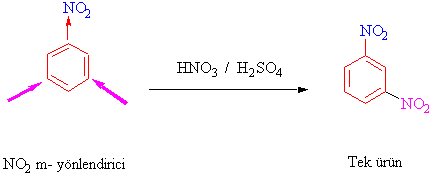
Yönlendirmenin iki tür olma sebebine kısaca bir bakalım.
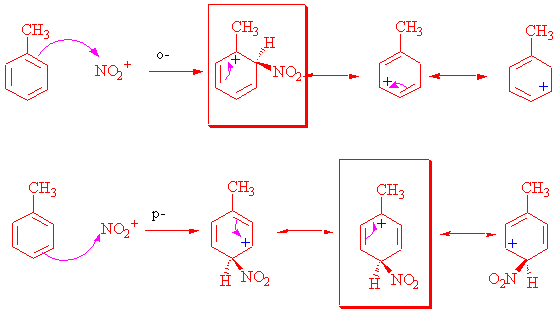
o- ve p- ataklarda kararlı karbokatyonun oluşumuna özellikle dikkat ediniz!! Meta atakta ise kararlı karbokatyon oluşamamasına !!
Yukarıdan da anlaşılacağı üzere elektron veren bir grup 0-, p- ya bağlanan ikinci grubun pozitif yükünü daha kararlı kılabilmekte, elektron çeken bir grup ise m-konumundaki + yüke daha kararlı olabilmektedir.
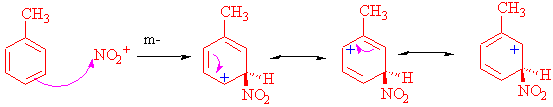
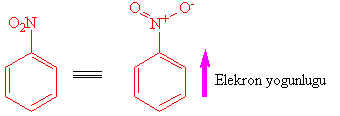
m-Yönlendirici olarak, nitro-grubu
Nitro grubu azot üzerinde pozitif, oksijen üzerinde negatif yük yoğunluğu ile rezonansta bulunan bir yapıdır ve elektron çekici (deaktive eden) bir gruptur.
o-, p- atağını incelersek
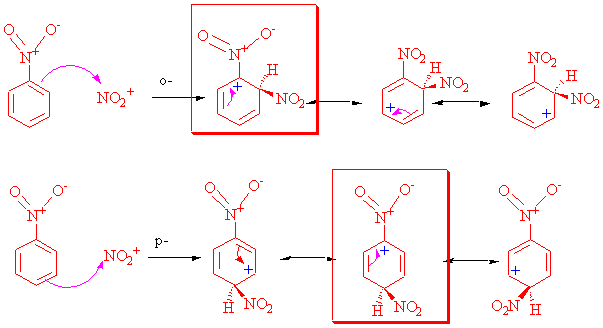
Çok dikkatli bakıldığında azot üzerindeki pozitif yükün, metil grubunun tersine, (N+) halka üzerinde rezonans yapan pozitif yükle yakın olmak istemeyeceği görülür.
m- atakta ise bu durum tersinedir, yani azotun direk bağlı bulunduğu karbona, rezonanstan dolayı her hangi bir pozitif yük gelmez.
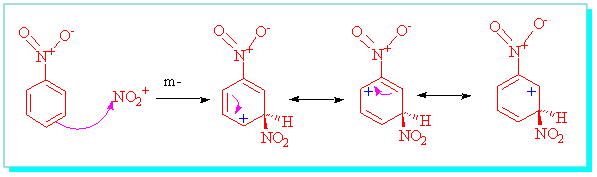
Meta konumunun rezonansı o-, p- ya göre daha tercih edilir yapıdadır ve nitro grubu meta (m-) yönlendirici bir gruptur.
Bazı yaygın substituentlerin yönlendiricilikleri aşağıdaki tabloda verilmekle birlikte, bağlı bulunan ilk grubun nereye yönlendireceğini ezbere bilmek zorunda da değiliz. Bazı genel kurallar bize yönlendirme etkisi hakkında bilgi verir. Bu bilgiler tablodan sonra kısaca anlatılacaktır.
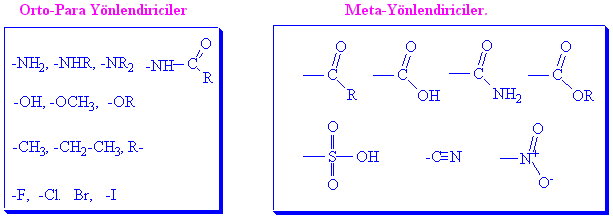
Yukarıdaki atom ve gruplara bakarak,
1-Benzene direk bağlı atomlar üzerinde elektron çifti bulunan tüm atomlar orto-, para- yönlendiricilerdir.
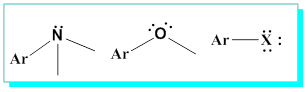
2-Benzene direk bağlı atomlar eğer çoklu bağlarla konjuge olabilir durumda iseler-çiftli ya da üçlüye komşu- meta- yönlendiricidirler.
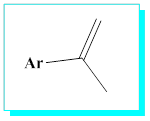
Birden fazla substituent bulunan bir aromatik yapı sentezlenecekse yönlendirmelere ve aktive-deaktive edici olma durumuna dikkat edilerek gruplara bağlanma sırasında öncelik tanınmalıdır.
S/ m-Bromo nitrobenzen ve p-bromo nitrobenzenin benzenden hazırlanış denklemlerini yazınız.
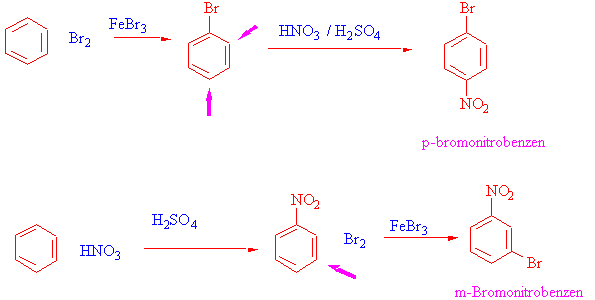
S/ p-nitrotoluen ve m-klorobenzensulfonikasit sentezini de siz yazınız.