BÖLÜM II Bu Ders Notlarını İndir
2.ORGANİK MOLEKÜLLERDE FONKSİYONEL GRUPLAR VE İSİMLEMDİRMELER
Fonksiyonel gurup: Fonksiyonel gurup, bir molekülün kimyasal anlamda en aktif olan kısımları olarak tanımlanabilir. Bu tanıma göre alkenlerde çift bağ alkinlerde üçlü bağ fonksiyonel guruptur. Hetero atomlar içeren fonksiyonel guruplar içinse, karbon hetero atom arasındaki bağların kimyasal anlamda karbon-karbon arası bağlardan daha aktif olduğunu anlamak çok zor değildir. Daha elektro negatif atomlar olan hetero atomlar bağ polarlığı ve dipolmoment oluşumunda daha etkindir. Bu anlamda hetero atom içeren organik moleküllerde fonksiyonel grup, hetero atomun bulunduğu kısımdır ve ilerleyen derslerde bu gruplar ve özellikleri üzerinde detaylı bir şekilde durulacaktır.
2.1-HİDROKARBONLAR
Hidrokarbonlar, adından da rahatça anlaşılacağı gibi, yalnızca hidrojenden ve karbondan oluşan bileşiklerdir.
2.1.1 Doymuş Hidrokarbonlar (Alkanlar-Sikloalkanlar) :
Her bir karbonun SP3 hibriti yaptığı ve dolayısı ile de dört farklı atoma bağlandığı yapılardır. Alkanların genel formülü n-karbon sayısı olmak kaydı ile CnH2n+2 dir
n=1 için,
C1H2x1+2 = CH4 Metan
C=5 için
C5H2x5+2 = C5H12 Pentan .......
İsimlendirme sıralı olarak (Homolog seri) devam eder.
Sikloalkanlar-Halkalı bileşikler
Genel formülleri CnH2n dir. ve halka oluşumu için gerekli en az üç karbonlu sistem siklopropandan başlar.
DİKKAT Bu kapalı formülün alkenler ile aynı olduğunu akılda bulundurunuz!
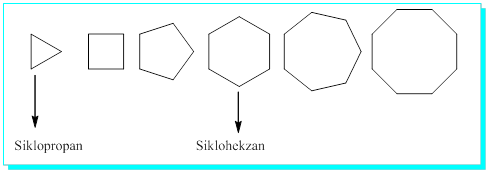
İsimlendirmeleri başlarına halkalı yapı olduğunu belirten Siklo-eki getirilmek suretiyle alkanların aynıdır.
2.1.2 Doymamış hidrokarbonlar (Alkenler-Alkinler).
Hidrokarbon molekülünde en az bir tane SP3 harici hibritleşme olduğu durumdur. En az bir tane ikili veya üçlü bağa sahip moleküllerdir.
2.2-ALKENLER:
Alkenler, yapılarında bir çift bağ içeren hidrokarbonlardır ve genel formülleri Cn H2n+2 dir.
NOT: Bu kapalı formülün sikloalkanlar içinde geçerli olduğuna ve yalnız bir çift bağ olduğu andaki genel formül olmasına dikkat ediniz!!
İki karbon atomu arasında bir çift bağ oluşturulması için en az iki karbon atomuna ihtiyaç vardır ve ilk alken molekülü n=2 ile başlar ve C2H2x2 = C2H4 Etendir.
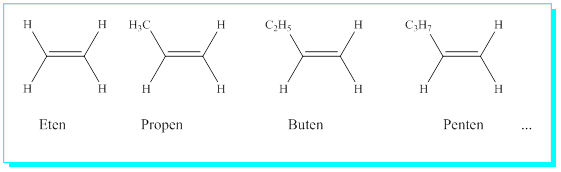
İsimlendirilmeleri alkanlardaki son -an eki yerine -en eki getirilerek yapılır.
Benzenin bir konjuge (Sıralı) tri-en olduğuna dikkat ediniz.
2.3-ALKİNLER:
Alkinler, yapılarında bir üçlü bağ içeren hidrokarbonlardır ve genel formülleri CnH2n-2
NOT: Bu kaplı formülün iki tane çift bağa da uyğun olduğuna dikkat ediniz.
n=2 için
C2 H2x2-2 C2H2 Etin.

İsimlendirilmeleri alkanlardaki son -an eki yerine -in eki getirilerek yapılır. + karbonlu yapıdan sonra üçlü bağın nerede olduğu rakamlarla ifade edilmelidir.
2.4 TEK HETERO ATOMLU FONKSİYONEL GURUPLAR
Hidrokarbonların bu açıklamalarından sonra hetero atom içeren onemli fonksiyonel guruplar inceleyelim. Hetero atom olarak Oksijen, Azot, Kükürt, ve halojenler üzerinde durulacaktır.
2.4.1 Yalnız Halojen İçeren Fonksiyonel Guruplar.
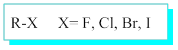
Haloalkanlar ya da alkil halojenürler:
· Halojen adları- Floro, Kloro, Bromo, Iyodo ve alkan adı getirilerek isimlendirilir.
· Alkil ismi -halojen ismi ve -ür eki getirilerek.

2.4.2 Yalnız Oksijen İçeren Organik Bileşikler
Oksijen türevlerini
· Su-molekülü benzerleri yapılar
· Karbonilden türeyenler olarak ikiye ayırmak mümkündür.
Su molekülü benzerleri;
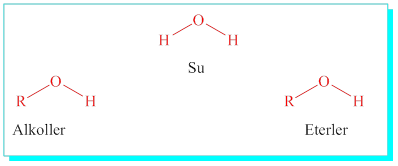
· Alkoller: su molekülünde hidrojen atomlarından birinin yerine bir alkil grubunun yer değiştirmesi ile oluşan moleküllerdir. Aklan duruyormuş gibi adı söylendikten sonra ol eki getirilir. Metanol, Etanol, Propanol vb.
· Eterler: Su molekülündeki her iki hidrojeninde alkil grupları ile yerdeğiştirmeleri sonucu elde edilen yapılardır. 1. Alkilin adı 2. Alkilin adı ve eter eki getirilerek adlandırılırlar.

Karbonilden türeyenler;
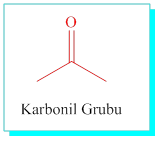
Karbonil grubu, bir karbon atomuna bir oksijen atomunun çift bağlı olduğu yapıdır. Karbonil grubunda ilk v tek karbonlu yapının H-CO- kuraldışı olarak Form-, iki karbonlu yapının ise CH3-CO- Aset-olarak adlandırıldığı akılda tutulmalıdır.
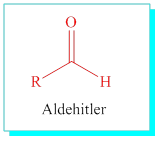
Aldehitler: İlgili karbon atomunun bir tarafına hidrojen diger tarafına bir alkil gurubu bağlı moleküllerdir. Her iki tarafa da hidrojen bağlı olan ilk yapı özeldir ve formaldehit olarak ya da metanal olarak adlandırılır.
Diğerleri, alkan ismi ve -al eki ile adlandırılırlar.
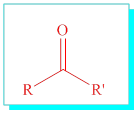
Ketonlar : İlgili karbon atomunun her iki tarafınada alkil gurupları bağlı moleküllerdir.
· Birinci alkil adı+ ikinci alkil adı+ keton eki ile adlandırılırlar.
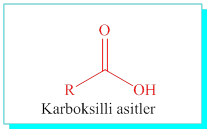
Karboksilik asitler: Karboksilli asitler karbonil grubuna OH gurubu bağlı yapılardır, karbonil karbonunu da içerecek şekilde, karbon sayısına göre alkan ismi ve oik asit eki ile isimlendirilirler.
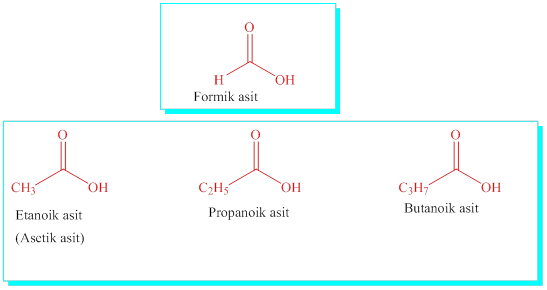
HCO2H, CH3CO2H, tek karbonlu ve iki karbonlu yapıdadır, bunlar önceden de hatırlanacağı üzere formik asit (Metanoik asit) ve asetik asit (Etanoik asit) olarak adlandırılır. Daha sonraki sıra ise, Propanoik asit, Butanoik asit, Hekzanoik asit vb. devam eder.
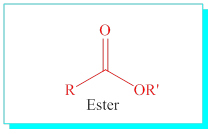
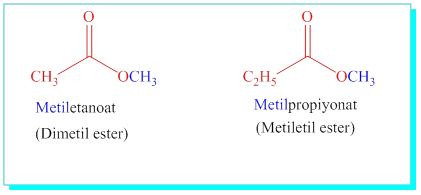
Esterler: Karbonile OR gurubu bağlı yapılardır, R alkilinin ismi ve R alkanının karbon sayısına göre ismi ve -oat eki ile veya R alkilinin ismi R alkilinin ismi ve ester takısı ile adlandırılırlar
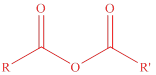
Anhidrit: İki karboksilli asitten bir su molekülü çıkarılması ile elde edilen yapı olarak düşünülebilir. Karboksilik asit anhitridi diye de adlandırılır. R ve R karboksilik asitleri ve anhidrit eki ile adlandırılır.
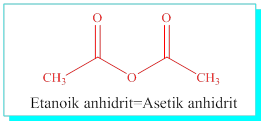
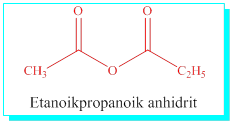
NOT: Her iki alkil gurubunun aynı olduğu durumda karboksilli asit adı sadece bir defa yazılır.
2.4.3-Yalnız Azot İçeren Organik Bileşikler (Aminler)
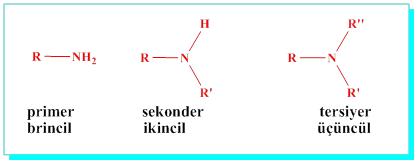
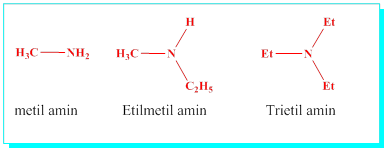
Aminler: Azot atomuna bağlı alkil guruplarının adları ve -amin eki getirilerek adlandırılırlar.
2.4.4-Yalnız Kükürt İçeren Organik Bileşikler.
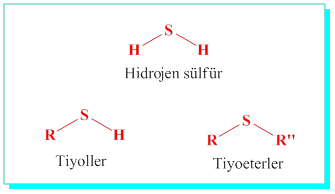
Tiyoller: Tiyoller adlandırılırken, kükürte bağlı alkilin alkan ismi ve -tiol eki getirilerek adlandırılır.
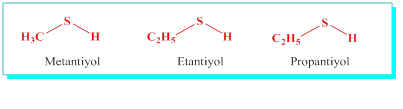
Metantiyol, Etantiyol vb.

Sülfitler: (Tiyoeterler) Her iki taraftaki alkillerin ayrı ayrı isimleri v sonuna -sülfit eki getirilerek adlandırılır.
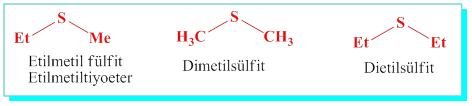
Metiletil sulfit. , Dimetil sulfit, dietil sulfit vb.
2.5 İKİ HETERO ATOMLU FONKSİYONEL GURUPLAR
2.5.1- Oksijen ve Azot İçeren Bileşikler
![]()
Nitro Bileşikleri: Nitro eki önce söylenmek kaydıyla Nitro-alkan olarak adlandırılır.

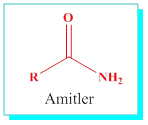
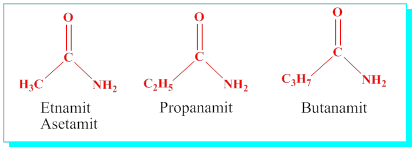
Amitler: Karbonil grubuna NH2 bağlı yapılardır, Karbonil karbonunu da içerecek şekilde alkan ismi ve -amit eki getirilerek adlandırılır.
2.5.2 Oksijen ve Kükürt İçeren Bileşikler
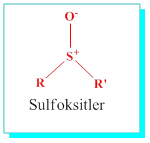
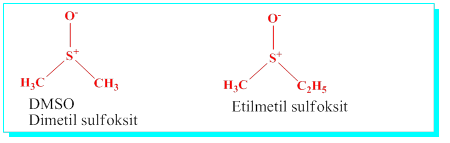
Sulfoksitler: R- Alkil ismi, R alkil ismi ve -sulfoksit eki getirilerek adlandırılır.
2.6 ORGANİK MOLEKÜLLERDE ASİTLİK BAZLIK
Organik reaksiyonlarda reaksiyonun yönünü ve ihtimalleri tahmin etmede en önemli faktörlerden biri de organik molekülde bulunan atomlara ve bunların elektronegativitelerine bağlı olarak asidik ya da bazik karakterini tahmin etmektir.
Asitlik ve bazlık için bilinen iki önemli tanımlama vardır. Bunlardan birincisi Brönsted-Lowry teoremidir ki: Asit proton (H+ iyonu) veren baz ise proton alan moleküller olarak tanımlanır.

Her ne kadar hidroklorik asit ve sodyum hidroksit sıkça karşılaştığımız ve sıkça kullanılan anorganik bazlar ise de, organik moleküllerde en sık karşılaşılan ve en çok bilinen asit türevleri karboksili asitlerdir.
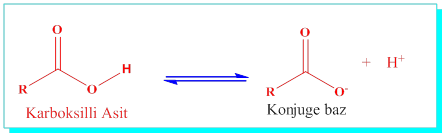
Bir karboksilik asidin proton verme eğilimi nasıl açıklanabilir. Genelde oksijene bağlı olduğu ve oksijeninde elektron çekici özelliği gereği indüktif olarak hidrojenden elektron çektiği ve hidrojeninde elektron kaybederek pozitifleştiği şeklinde açıklansa da, bu düşünce alkollerde de oksijen ve hidrojen bağı olduğu, ama alkollerin asidik davranmadığı savunusu ile bu düşüncenin yetersiz olduğu açığa çıkar. Karboksillli asitlerin asidik davranmasının altında yatan etki indüktif değil mezomerik etkidir.

· Oksijen atomları bağlı bulundukları karbon ve hidrojen atomlarına göre daha elektronegatif dirler. Oksijen atomları hem hidrojenden hem de bağlı bulunduğu karbon atomundan indüktif olarak elektron çekerler.
· Bunun yanında ve daha da önemlisi, kopan protondan sonra geriye kalan oksijen anyonu ve bu anyon üzerindeki yükün taşınabilirliğidir. Negatif yük karbon atomu üzerinden komşu karbonilin p-* orbitalleri ile etkileşerek, rezonansa girer ve yükünü diğer oksijen atomuna dağıtır. En kötü ihtimalle yük yarıya düşmüş ve taşınabilirlikte belki iki katına çıkmıştır.
· Alkollerde böyle bir durum yoktur, alkolden ayrılan proton ve geriye kalan oksijen anyonu (alkolat) düşünüldüğünde, oksijen üzerindeki yükün delokalize olabileceği bir yer yoktur ve tüm yükü oksijen atomu kendisi tek başına taşımak zorundadır.

Baz olarak sodyum ve potasyum hidroksit yanında, azot üzerindeki elektron çiftlerinden dolayı amin türevleri, alkollerin konjuge bazları- alkoksitler kullanılmaktadır.

Bazı moleküllerin verebilecek protonları olmadığı halde asit olarak davranmasını Brönsted-Lowry tanımlaması açıklayamaz. Örnek olarak bortriflorür, (BF3) alüminyum klorür (AlCl3) güçlü birer asit olarak davranmalarına rağmen üzerlerinde verebilecekleri protonları yoktur. Bunlar Lewis asit baz tanımı: Elektron alanlar asit elektron verenler bazdır, tanımı ile açıklanabilirler ve bu tür maddelere genel olarak Lewis asitleri bunlara elektron veren, genelde üzerinde elektron çifti bulunduran maddelere de Lewis bazı denir.
Bunlardan Bortriflorürü inceleyelim. Bor atomu 5 tane protona sahip bir elementtir ve SP2 hibritleşmesi yapar.
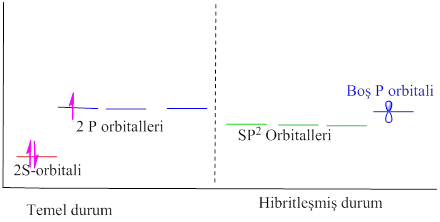
Hibritleşme sonunda bir tane hibrite katılmayan boş P orbitali kalır ki bu orbital de elektron almaya müsaittir ve asit olarak davranma sebebi bu boş orbitalin elektron alma isteğidir.

Yukarıda verilen bilgiler ışığında AlCl3 ve FeCl3 lewis asitlerini de siz inceleyiniz.